Причины и механизмы развития болезни Дарье
а) Эпидемиология. Болезнь Дарье (БД) (OMIM #124200) — аутосомно-доминантное заболевание, поражающее оба пола и все этнические группы. Впервые заболевание было независимо описано Дарье и Уайтом в 1889 году (оно известно также как болезнь Дарье-Уайта или фолликулярный кератоз). Распространенность БД оценивается от 1 случая на 30000 населения (северо-восточная Англия, Шотландия, Словения) до 1 случая на 100000 населения (Дания). Пенетрантность полная, но часто отмечаются спонтанные мутации.
б) Этиология и патогенез болезни Дарье. Ген болезни Дарье (БД) был картирован методом анализа сцеплений на участке хромосомы 12q23-24 в 1993 году, а АТР2А2 был идентифицирован как дефектный ген в 1999. АТР2А2 кодирует изоформу 2 Са2+ аденозинтрифосфатазы (АТФазы) сарко-эндоплазматическогого ретикулума (SERCA2), которая является кальциевым насосом, транспортирующим Са2+ от цитозоля к люмену эндоплазматического ретикулума (ЭР). Болезнь Дарье (БД) вызывается мутациями, инактивирующими один аллель АТР2А2.
АТР2А2 занимает 76 килобаз (kb), состоит из 21 экзона и кодирует транскрипт размером 4,4 kb, который альтернативно сплайсирован на три изоформы: (1) SER-СА2а, (2) SERCA2b и (3) SERCA2C. Изоформа SER-СА2а экспрессирована в медленно сокращающихся скелетных мышцах и сердечной мышце, которые при БД не поражаются. SERCA2b and SERCA2c экспрессированы повсеместно, но SERCA2b является основной изоформой, обнаруженной в эпидермисе человека.
Специфические мутации SERCA2b являются достаточными для того, чтобы вызвать болезнь Дарье (БД) (несмотря на наличие функционирующей SERCA2a), что подтверждает важную роль SERCA2b в эпидермисе. Большинство тканей могут компенсировать дефицит SERCA2 такими механизмами, как SERCA3, который не экспрессирован в кератиноцитах.
Насосы SERCA2 принадлежат к семейству Са2+-АТФаз P-типа. Эти насосы катализируют гидролиз аденозинтрифосфата (АТФ) в сочетании с транслокацией двух ионов Са2+ от цитозоля к люмену ЭР, где Са2+ хранится в высоких концентрациях. Насосы SERCA охватывают три цитоплазматических домена [(1) домен-активатор, (2) домен фосфориляции и (3) АТФ-связывающий домен], соединенные с трансмембранным доменом десятью трансмембранными спиралями, которые содержат два связывающих Са2+ сайта. После связывания цитозольных ионов Са2+ и фосфориляции, насос подвергается конформационным изменениям и выделяет Са2+ в люмен ЭР.
Сообщалось о более чем 140 патогенных мутациях АТР2А2, включая миссенс-мутации (50%), мутации рамки считывания (23%) и делеции или вставки без сдвига рамки считывания (8%). Устойчивой корреляции между генотипом и фенотипом не установлено, но миссенс-мутации могут ассоциироваться с более тяжелыми формами заболевания. Значительная фенотипическая вариабельность указывает на модификацию фенотипа другими генетическими факторами или воздействиями окружающей среды.
Хотя этиология заболевания понятна, патогенез болезни Дарье (БД) менее ясен. Для нормальной межклеточной адгезии и дифференцировки кератиноцитов необходимы высокие концентрации Са2+. В норме градиент Са2+ в эпидермисе возрастает от базального к поверхностному слоям, о при болезни Дарье (БД) этот градиент нарушен. Уровень Са2+ понижен в базальных клетках пораженной и непораженной кожи. Самым ранним ультраструктурным изменением является разрушение десмосом со скоплением кератиновых филаментов вокруг клеточного ядра.
Иммуногистологическое исследование акантолитических клеток выявляет интернализацию десмосомальных компонентов. Дискератотические клетки эпидермиса (гранулы, круглые тельца) формируются посредством апоптоза, который запускается при утрате адгезии. Экспрессия антиапоптотических белков в семействе генов Bcl-2 при БД понижена, что, возможно, является вторичным феноменом, но изменения в белках Bcl-2 могут также способствовать апоптозу.
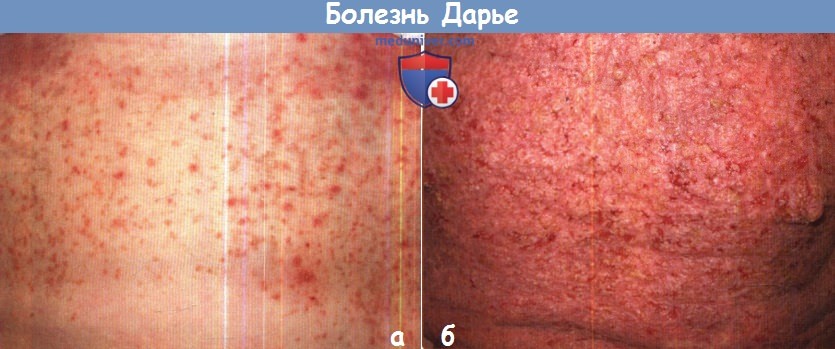
б - Неприятно пахнущие, сливающиеся кератотические папулы на груди с трещинами и гиперкератозом сосков при болезни Дарье.
Насосы SERCA восполняют пул Са2+ в ЭР из цитозольных Са2+, но мутации, разрушающие важные функциональные домены, уменьшают активность насоса при БД. Уменьшенный пул Са2+ в ЭР может нарушить процессинг десмосомальных белков, воздействуя на функцию молекулярных шаперонов, таких как калретикулин и калнексин, которые предотвращают неправильную укладку белков и участвуют в посттрансляционной модификации.
Внутриклеточная сигнализация, высвобождая Са2+ в эндоплазматический ретикулум (ЭР), регулирует транспорт белков к клеточной мембране, в том числе необходимых для сборки десмосом и адгезионных контактов. В культивированных кератиноцитах БД нарушен транспорт десмоплакина к клеточной мембране. Вариации в клеточной концентрации Са2+, вероятно, также влияют на экспрессию Са2+-зависимых генов, которые участвуют в дифференцировке и адгезии кератиноцитов. Эпидермис папилломатозный, и дифференцировка происходит аномально, с экспрессией гиперпролиферативных кератиноцитов и преждевременной экспрессией предшественников рогового конверта, таких как инволюкрин. Изменения в АТФ-опосредуемой сигнализации могут способствовать дискератозу и гиперпролиферации.
Внеклеточный Са2+ связывается с пруринергическими АТФ-рецепторами, которые передают кальциевые сигналы в цитозоль. Активация сцепленного с G-белком АТФ-рецептора (P2Y) генерирует инзитол 1,4,5-трифосфат (IP3), мессенджер кальциевой сигнализации. Связываясь с поверхностными рецепторами на ЭР и аппарате Гольджи, IP3 запускает выделение запасов Са2+ и повышение концентрации цитозольного Са2+, что активирует дальнейший приток внеклеточного Са2+ через Са2+-каналы плазматической мембраны (управляемое запасами поступление Са2+), включая транзиторный рецепторный потенциал каноникол 1 (TRPC1). При БД делеция Са2+ в ЭР активирует TRPC1 и усиливает приток Са2+.
Повышенная цитозольная концентрация Са2+ может стимулировать пролиферацию кератиноцитов, активируя Са2+-зависимые системы мессенджеров, которые регулируют деление и дифференцировку клеток.
У мышей с пониженным содержанием SERCA2 развиваются папилломы и плоскоклеточные карциномы. Гаплонедостаточность по SERCA2 в культивированных кератиноцитах мышей связана со стимулированием пролиферации, но с инакативацией дифференцировки.
При болезни Дарье (БД) о плоскоклеточных карциномах сообщается редко, иногда в ассоциации с ВПЧ 16.
В большинстве случаев кожа способна компенсировать дефицит SERCA2, повышая экспрессию нормального аллеля SERCA2 или активируя другие механизмы, такие как секреторный механизм изоформы 1 Са2+/Mn2+-АТФазы (SPCA1) в аппарате Гольджи.
Однако внешние факторы, такие как ультрафиолетовое излучение спектра В (УФВ), или трение, которые, как известно, ухудшают БД, могут нарушить этот хрупкий баланс, инактивируя АТР2А2 или повышая потребность в SERCA2, пока белок не достигнет критического уровня.
Эту гипотезу подтверждает тот факт, что УФВ-облучение и провоспалительные цитокины уменьшают уровни мРНК в культивированных нормальных кератиноцитах и что ретиноиды и кортикостероиды (применяемые для терапии болезни Дарье (БД)) препятствуют их уменьшению.
Литий, еще один хорошо известный триггер болезни Дарье (БД), уменьшает экспрессию SERCA2 в эпидермисе крыс.
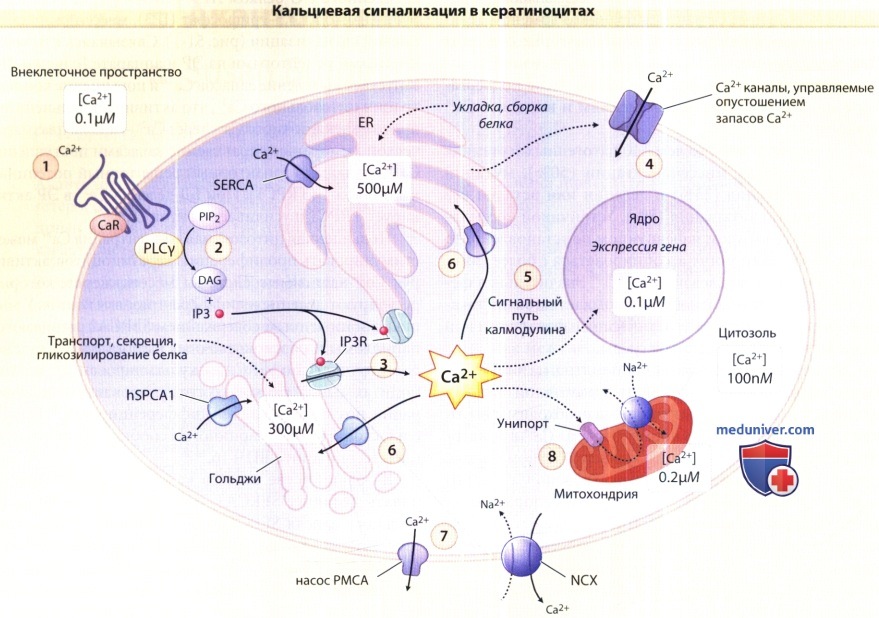
1. Са2+, связываясь с рецептором плазматической мембраны кератиноцитов (CaR), активирует фосфолипазу Су (PLC у).
2. Это приводит к гидролизу фосфатидилинозитола 4,5-бифосфата (PIP2) в инозитол 1,4,5-трифосфат (IРЗ) и диацилглицерол (DAG).
3. IP3 связывается со своим рецептором (IP3R) на поверхности эндоплазматического ретикулума (ER) и аппарата Гольджи, что приводит к депелеции внутриклеточных запасов и вызывает повышение внутриклеточных уровней Са2+.
4. Это повышение запускает открытие активируемых высвобождением Са2+ каналов в плазматической мембране, что приводит к устойчивому повышению внутриклеточных уровней Са2+.
5. Са2+ связывается с калмодулином; это активирует кальциневрин и каломодулин-зависимые протеинкиназы, которые регулируют транскрипцию гена путем фосфо-риляции/дефосфориляции факторов транскрипции.
6. Активный транспорт Са2+, осуществляемый различными насосами аденозинтрифосфатазы (АТФазы) сарко-эндоплазматического ретикулума (SERCA1 —SERCA3) и насосом секреторного механизма Са2+/Mn2+-АТФазы (SPCA1) играет важную роль для восполнения запасов ER и аппарата Гольджи соответственно. SPCA1 необходим также для притока Mn2+ в аппарат Гольджи (здесь не показано).
7. Отток Са2+ во внеклеточное пространство осуществляется с помощью Са2+-АТФаз плазматической мембраны (РМСА) и обменников Na+/Ca2+ (NCX).
8. Митохондрии захватывают Са2+, выделившийся из внутренних запасов по время Са2+-сигнализации через Са2+-унипорт, и возвращают его в цитозоль через NCX. Таким образом для гомеостаза Са2* требуются различные концентрации Са2+ в цитозоли, сарко-эндоплазмиатическом ретикулуме, аппарате Гольджт, митохондриях и ядре клетки.Самый крупный запас клеточного Са2+ находится в проствете ER и в Са2+-связывающих белках. Са2+ -сигнализация регулируется и генерируется притоком Са2+ через его рецепторы, высвобождением из внутренних запасов (ER, аппарат Гольджи, митохондрия) и секвестрацией Са2+-насосами (SERCAs, SPCA1) и Са2+ -обменниками. mNCX = митохондриальный обменник Na2+/Ca2+.
- Рекомендуем далее ознакомиться со статьей "Симптомы и клиника болезни Дарье"
Оглавление темы "Болезнь Дарье.":
