Кератиновые белки промежуточных филаментов клеток кожи
Несмотря на различия в последовательностях, все кератины обнаруживают трехчастную структуру домена, типичную для белков, образующих промежуточные филаменты. Центральный домен состоит из расширенной а-спирали с длинными гептадными повторами, которые опосредуют биспиральную димеризацию. Такой «палочковидный» домен содержит примерно 310 аминокислот и фланкирован высоко вариабельными последовательностями головного N-концевого и хвостового С-концевого доменов.
Ни один из данных концевых доменов не экспонирует никаких иных известных мотивов, кроме глициновых петель, наблюдаемых у эпидермальных кератинов.
На поверхности филамента головной и хвостовой домены открыты доступу протеазы. Здесь они могут вступать во взаимодействие с соседними филаментами или другими белками, а также служить субстратами для пост-трансляционных модификаций, участвующих в их регулировании. Принимая во внимание гетерогенность размеров и первичной структуры головного и концевого доменов, можно предполагать, что они играют ключевую роль в функционировании и регулировании кератиновых белков in vivo.
Центральный палочковидный домен кератинов является главным детерминантом самосборки, однако немаловажно участие в этом процессе и головного домена.
Сборка начинается с образования гетеродимеров, в которых имеющие структуру а-спирали центральные «прямые» домены кератина I и II типа укладываются параллельно, точно совмещаясь друг с другом. Гетеродимеры взаимодействуют по своей латеральной поверхности, соединяясь конец в конец, чтобы, в итоге, образовать филаменты толщиной 10-12 нм, которые в зависимости от типа белков промежуточного филамента и условий сборки в поперечном сечении могут содержать различное число субъединиц.
Зрелые промежуточные филаменты лишены структурной полярности, что является прямым следствием антипараллельной ориентации образующих их биспиральных димеров. Исключительная стабильность составляющих кератины структур свидетельствует о тесной взаимосвязи между кератинами типа I и типа II. Большая часть (более 95%) внутриклеточного пула кератиновых белков полимеризована. Исследования культуры клеток эпителия показали, что сборка промежуточных кератиновых филаментов начинается на периферии клетки, вблизи цитоскелета кортикального F-актина.
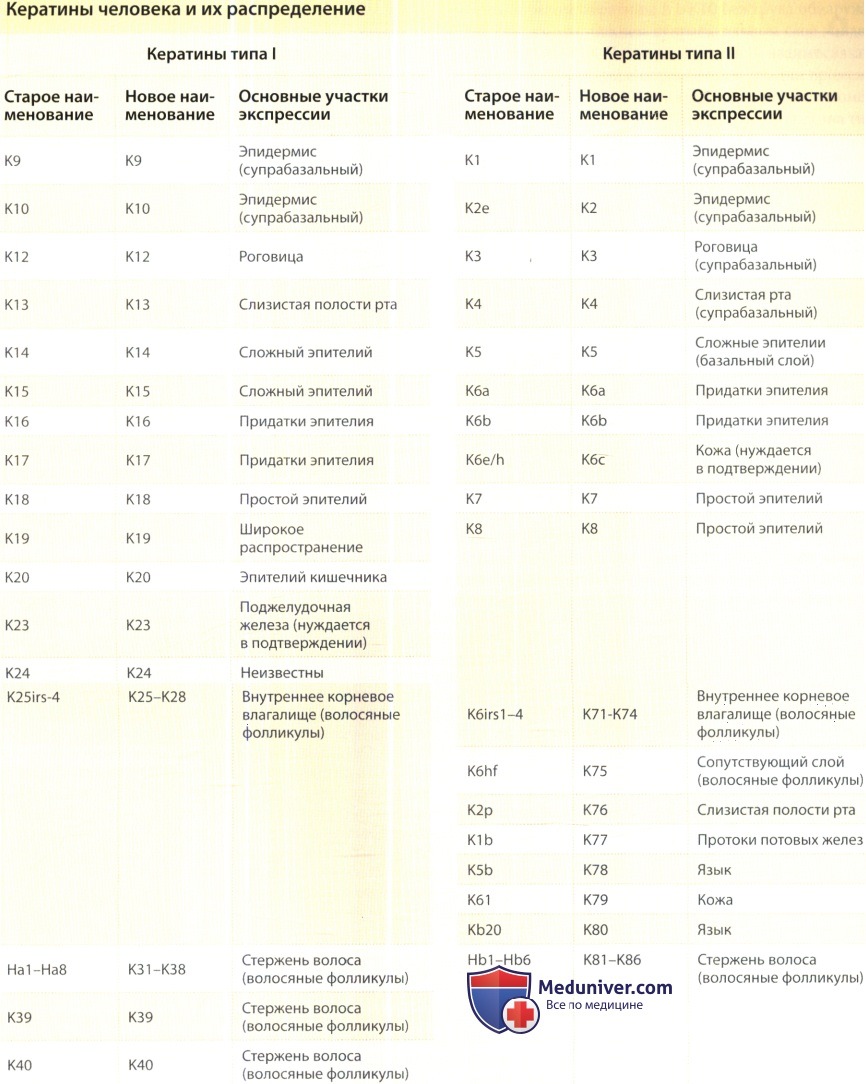
Кератины образуют основную сеть промежуточных филаментов практически во всех эпителиальных клетках. Численность промежуточных филаментов кератинов и способ их организации различаются в зависимости от вида эпителия. В большом количестве (от 10 до 80% всех клеточных белков) кератиновые белки присутствуют в поверхностном плоскоклеточном эпителии (например, в эпидермисе, слизистой полости рта, эпителии роговицы и т.п,). В эпителиальных клетках подобных тканей промежуточные филаменты организованы в сеть, охватывающую всю цитоплазму.
Такая сеть простирается от поверхности ядра до периферии цитоплазмы, где филаменты прикрепляются к мембране в участках клеточного матрикса и межклеточной адгезии (полудесмосомы, десмосомы). Меньшим числом представлены кератины в простом эпителии (например, в эпителии печени, кишечника, поджелудочной железы и т.п.). В таких тканях поляризованные эпителиальные клетки часто содержат асимметрично организованные промежуточные филаменты кератинов, сконцентрированных главным образом на периферии цитоплазмы, нередко — на апикальном полюсе.
В столь различных условиях организация и регулирование кератиновых промежуточных филаментов осуществляются при участии ряда ассоциированных белков. Некоторые из них способствуют организации кератиновых филаментов в пучки (филагрин, трихогиалин), другие — соединению промежуточных филаментов с микротрубочками и микрофиламентами (плектин или изоформы BPAG) и/или с десмосомами или полудесмосомами (десмоплакин, плакофилин, изоформы BPAG и т.п.). Наличие других белков-партнеров, таких как TRADD, белок 14-3-3, Akt (протеинкиназа В), подтверждает участие кератиновых промежуточных филаментов в сигнальных механизмах, что является открытием последних лет.
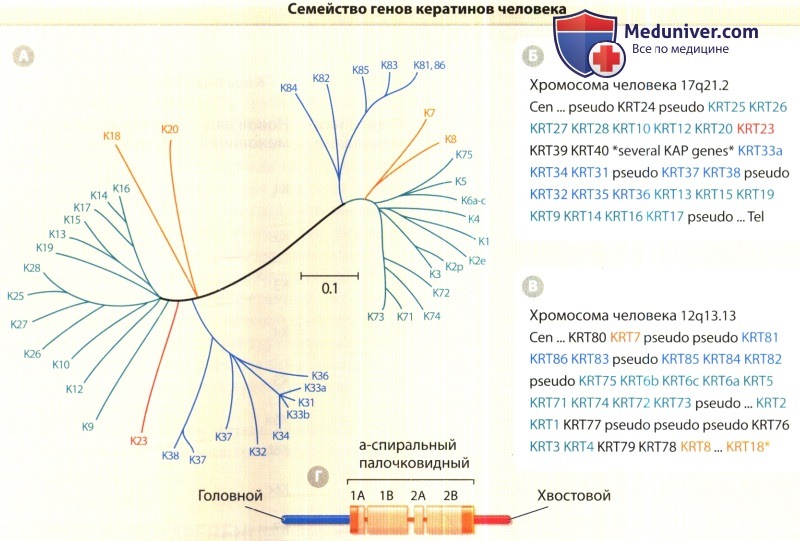
А. Сравнительная схема базовой структуры кератинов человека, построенная с применением компьютерных программ ClustaW и TreeView.
Связанность последовательностей обратно коррелирует с длиной линий, соединяющих различные последовательности, а также с количеством и месторасположением точек ответвления.
Для сравнения взяты последовательности головного и центрального палочковидных доменов каждого кератина.
Для большей ясности некоторые кератины в данной схеме не указываются. «Дерево» имеет два главных ответвления, соответствующих последовательностям кератинов типов I и II.
Каждая из частей этой ведущей дихотомии, в свою очередь, подразделяется на основные подгруппы (они обозначены разными цветами).
Б. Организация генов кератинов функционального типа I, сгруппированных у человека на хромосоме 17.
Исключением является К18 (помечен звездочкой в пункте В), находящийся на участке, граничащем с теломерой (Tel) группы генов типа II.
Большое число генов, кодирующих ассоциированные с кератинами протеины (КАР), прерывает группу генов типа I между KRT40 и KRT33A.
В. Организация функциональных генов кератинов типа II, сгруппированных у человека на хромосоме 12. Гены К8 и К18 разделяются 450000 пар оснований.
Г. Схематическое изображение трехчастной структуры домена, общей для всех кератинов и других белков промежуточных филаментов.
Центральный а-спиральный палочковидный домен выступает в качестве основного детерминанта самосборки.
Он разделен на субдомены 1 А, 1 В, 2А и 2В и фланкирован неспиральными «головным» и «хвостовым» доменами — N-концевым и С-концевым соответственно.
Оба конца палочковидного домена содержат от 15 до 20 участков аминокислот (обозначены красным цветом), в высокой степени консервативных у всех белков промежуточных филаментов Cen = центромера;
several КАР genes = несколько генов, кодирующих ассоциированные с кератинами протеины; pseudo = псевдоген (нефункциональный); tel = теломера.
- Рекомендуем далее ознакомиться со статьей "Экспрессия генов кератина при дифференцировке эпидермиса"
Оглавление темы "Гистология, физиология кожи.":- Клеточная и генная терапия стволовыми клетками эпидермиса
- Классификация кератинов человека
- Кератиновые белки промежуточных филаментов клеток кожи
- Экспрессия генов кератина при дифференцировке эпидермиса
- Функции кератина в эпидермисе и коже в целом
- Патология кератина как причина кожных болезней
- Роговой конверт эпидермиса - состав, функции
- Защитная и барьерная функция кожи как органа
- Строение и защитные функции рогового слоя эпидермиса кожи
- Липиды рогового слоя эпидермиса кожи и его барьерная функция

