Причины и механизм развития буллезного пемфигоида
- Обычно развивается в пожилом возрасте.
- Ежегодная смертность варьирует от 6% до 40%.
- Признаки заболевания: пруритические уртикарные очаги и крупные упругие пузыри; у отдельных пациентов наблюдаются эрозии слизистых оболочек.
- Гистологически выявляются субэпидермальные пузыри с эозинофилами.
- Прямая иммунофлюоресценция демонстрирует отложения компонента комплемента С3 и иммуноглобулина G (IgG) в зоне эпидермальной базальной мембраны. Непрямая иммунофлюоресценция выявляет сывороточные антитела IgG к антигену базальной мембраны.
- Аутоантигены буллезного пемфигоида BPAgle и ВР180 являются белками полудесмосом кератиноцитов — адгезионной структуры между базальными клетками и базальной мембраной.
- Терапия включает местные и системные кортикостероиды и иммуносупрессивные препараты.
Буллезный пемфигоид был впервые описан как уникальное заболевание с характерными клиническими и гистологическими признаками Вальтером Левером (Walter Lever) в 1953 году. Его отличие от пузырчатки было важным, поскольку тогда вульгарная пузырчатка часто приводила к летальному исходу, в то время как буллезный пемфигоид имел сравнительно хороший прогноз. Различие между буллезным пемфигоидом и пузырчаткой было полностью подтверждено характерными иммунопатологическими признаками этих заболеваний, которые были описаны примерно 12 спустя.
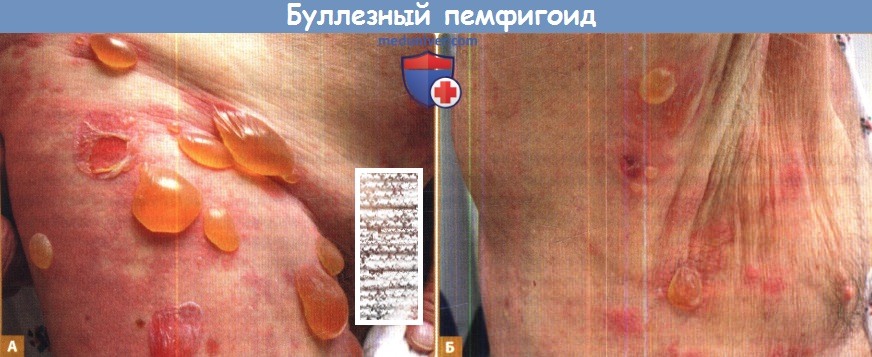
А. Крупные напряженные пузыри и эритематозные бляшки усеянные мелкими везикулами локализуются на бедрах и голенях.
Б. Уртикарные очаги буллезного пемфигоида с расположенными на поверхности напряженными везикулами и пузырями в подмышечной области.
а) Эпидемиология буллезного пемфигоида. Буллезный пемфигоид типично развивается у пациентов старше 60 лет, пик заболевания приходится на 70-лет-ний возраст. Имеются отдельные сообщения о буллезном пемфигоиде у младенцев и детей, хотя эти случаи редки. Среди больных буллезным пемфигоидом отсутствуют предпочтения по этнической, расовой и гендерной принадлежности. Заболеваемость буллезным пемфигоидом составляет примерно 7 случаев на миллион человек в год во Франции и Германии, 14 случаев на миллион населения в год в Шотландии.
Недавнее когортное исследование указывает, что заболеваемость буллезным пемфигоидом в Великобритании может составлять 43 случая на миллион человек в год, причем в последние несколько лет заболеваемость растет.
б) Этиология и патогенез буллезного пемфигоида. Отличительными признаками буллезного пемфигоида являются наличие субэпидермальных пузырей, полиморфноядерных клеточных инфильтратов в верхних слоях дермы очаговой и периочаговой кожи, а также аутоантител IgG и С3, связанных с дермо-эпидермальным соединением. В последние десятилетия был достигнут значительный прогресс в описании этих антигенов как компонентов полудесмосом и в создании модели на животных, которая показала патогенность аутоантител буллезного пемфигоида.
1. Антигены буллезного пемфигоида. Метод иммунофлюоресценции (ИФ) показывает, что в крови и тканях пациентов с буллезным пемфигоидом имеются аутоантитела, направленные против антигенов зоны базальной мембраны кожи. Иммунологические исследования методом электронной микроскопии определили локализацию антигенов буллезного пемфигоида в полудесмосоме, органелле, важной для прикрепления базальной клетки к подлежащей базальной мембране. Эти аутоантитела связываются как с внутриклеточной пластинкой полудесмосомы, так и с её внеклеточным участком.
При иммуноблоттинге экстрактов кожи человека антитела буллезного пемфигоида распознают два характерных антигена с молекулярным весом 230 кДа и 180 кДа. Молекула массой 230 кДА обозначается как ВР230, BPAG1 или BPAG1e. BPAG1e принадлежит к семейству генов, которое включает десмоплакин-1, белок десмосомальной пластинки, важный для прикрепления промежуточных филаментов кератина к десмомоме. Методом иммуноэлектронной микроскопии локализация BPAG1e установлена во внутриклеточной пластинке полудесмосомы, в том месте, куда входят промежуточные филаменты кератина. Анализ штаммов мышей с дефицитом BPAGle, полученных с применением трансгенной нокаутной технологии, показал, кроме того, что функцией BPAG1e является прикрепление промежуточных филаментов кератина к полудесмосоме. У мышей с отсутствием BPAG1e наблюдается хрупкость базальных клеток вследствие разрушения сети кератиновых филаментов, но без дефекта эпидермально-дермальной адгезии.
Интересно отметить, что альтернативно сплайсированная форма BPAGle (обозначаемая BPAG1n) экспрессирована в нервной ткани. BPAG1n стабилизирует цитоскелет сенсорных нейронов, также как BPAG1e стабилизирует цитоскелет эпидермальных клеток. Отсутствие нарушений в дермо-эпидермальном соединении у мышей, нокаутных по BPAG1e, указывает на то, что действие патогенных аутоантител при буллезном пемфигоиде не сводится к простой блокировке функции BPAG1e.
Аутоантиген ВР с молекулярным весом 180 кДА обозначается как ВР180, BPAG2 или коллаген типа XVII. ВР180 — это трансмембранный белок с внутриклеточным амино-терминальным доменом и удлиненным карбоксильно-терминальным доменом, который занимает светлую пластинку и проникает в плотную пластинку базальной мембраны. Его цитоплазматический домен расположен в пластинке полудесмосомы, а внеклеточный домен связан с якорными филаментами. Внеклеточный домен ВР180 содержит ряд из 15 участков коллагена, прерываемых 16-ю неколлагеновыми последовательностями. Субдомен NC16A, примыкающий к мембранному участку, содержит основные эпитопы, реагирующие с антителами. Эти признаки делают антиген ВР180 основной мишенью для патогенных аутоантител.
Антитела против домена NC16A способны индуцировать субэпидермальные пузыри у мышей. Кроме того, твердофазный иммуноферментный анализ (ELISA) для определения антител к домену ВР180 NC16A является как чувствительным, так и специфичным для диагностики буллезного пемфигоида,а его титры коррелируют с активностью заболевания. Дополнительно, данные о том, что ВР180 опосредует дермо-эпидермальную адгезию получены в результате анализа генного дефекта у пациентов с субэпидермальным пузырным заболеванием пограничной зоны, пограничным буллезным эпидермолизом не-Герлитца, ранее известным как генерализованный атрофический доброкачественный буллезный эпидермолиз. У таких пациентов рецессивно наследуемые мутации в гене ВР180 приводят к отсутствию или дефициту белка.
2. Патофизиология субэпидермальных пузырей. Буллезный пемфигоид является аутоиммунным воспалительным заболеванием. Характерный признак буллезного пемфигоида — присутствие в крови и тканях аутоантител против ВР180 и ВР230. В сыворотке буллезного пемфигоида присутствуют аутоантитела против ВР180 различных изотопов иммуноглобулинов и подклассов IgG, при этом преобладает IgG, за ним следует IgE.. Сывороточные уровни IgG и IgE-антител против BP180-NC16A у пациентов с буллезным пемфигоидом коррелируют с активностью заболевания. Воспалительные клетки присутствуют в верхних слоях дермы и в буллезной полости, в том числе эозинофилы (преобладающий тип клеток), нейтрофилы, лимфоциты и моноциты/макрофаги. В дерме находятся как интактные, так и подвергающиеся дегрануляции эозинофилы, нейтрофилы и тучные клетки. Локальная активация этих клеток может происходить посредством многочисленных медиаторов воспаления, присутствующих в очаговой коже и/или в пузырной жидкости.
В пузырной жидкости буллезного пемфигоида выявляются несколько протеиназ, в том числе плазмин, коллагеназа, эластаза и матричная металлопротеиназа-9 (ММП-9), которые могут играть решающую роль в образовании субэпидермальных пузырей благодаря способности разлагать белки внеклеточного матрикса. Данные, полученные как in vitro, так и in vivo, показывают, что аутоантитела, особенно направленные против ВР180, являются патогенными. Исследования in vitro с применением срезов нормальной кожи человека указывают на то, что IgG буллезного пемфигоида способен приводить к отделению дермы от эпидермиса в присутствии комплемента и лейкоцитов.
Первоначальные попытки продемонстрировать патогенность аутоантител пациента в мышиной модели пассивного переноса оказались безуспешными, поскольку аутоантитела к антигену буллезного пемфигоида BP180-NC16A не вступали в перекрестную реакцию с мышиным ВР180. Чтобы преодолеть это затруднение, были получены кроличьи антитела против эпитопа на мышином ВР180. Пассивный перенос этих кроличьих антител неонатальной мыши вызывает появление пузырей, напоминающих некоторые ключевые признаки буллезного пемфигоида у человека, в том числе отложение in situ кроличьего IgG и мышиного С3 в зоне базальной мембраны, отделение эпидермиса от дермы и воспалительный клеточный инфильтрат. Эти исследования показывают, что для экспериментального образования пузырей у животных требуется активация классического пути системы комплемента, дегрануляция тучных клеток и инфильтрация нейтрофилов. В период прогрессирования заболевания происходит четко отлаженный протеолитический процесс. Плазмин активирует профермент ММР-9, а активированная ММП-9 затем разлагает ингибитор а1 -протеиназы, физиологический ингибитор нейтрофильной эластазы. Неконтролируемая нейтрофильная эластаза разлагает ВР180 и другие компоненты внеклеточного матрикса, что приводит к разделению дермо-эпидермального соединения.
Чтобы непосредственно протестировать патогенность IgG -аутоантител против ВР180 у пациентов с буллезным пемфигоидом, были выведены гуманизированные по ВР180 штаммы мышей, у которых мышиный ВР 180 или соответствующий домен был замещен человеческим ВР180 или доменом NC16A. У этих гуманизированных мышей, после инъекции IgG-антител против ВР180 от пациентов с буллезным пемфигоидом, развивались субэпидермальные пузыри. Как и в модели с кроличьими IgG-антителами против мышиного ВР180, в случае гуманизированной по NC16A мышиной модели буллезного пемфигоида также необходимы комплемент, тучные клетки и нейтрофилы.
IgE-аутоантитела против ВР180 также могут участвовать в образовании пузырей. В коже человека, пересаженной иммунодефицитным мышам, после введения IgE-гибридомы или общего IgE из сыворотки больных буллезным пемфигоидом во внеклеточный участок ВР180, наблюдалось гистологическое разъединение дермы и эпидермиса, что указывает на возможное участие в патогенезе буллезного пемфигоида IgE-антител против ВР180 путем активизации тучных клеток и привлечения эозинофилов.
Хотя исследования в моделях на животных четко показывают, что воспалительный каскад запускается специфическими антителами против ВР180 и играет важную роль в образовании пузырей, еще одним механизмом заболевания может быть прямое вмешательство аутоантител против ВР180 в опосредуемую полудесмосомами адгезию между клеткой и клеточным матриксом. Внекоторых моделях на животных предполагается также, что в процессе образования пузырей при буллезном пемфигоиде участвуют также аутоантитела против ВР230, однако прямые доказательства этого факта для организма человека отсутствуют. Вдобавок к гуморальному ответу, у пациентов с буллезным пемфигоидом отмечается также клеточно-опосредуемый иммунный ответ. Аутореактивные Т- и В-лимфоциты распознают ВР180. Эти исследования указывают на то, что буллезный пемфигоид является зависимым от Т- и В-клеток и опосредуемым антителами аутоиммунным заболеванием кожи.
Как и в случае большинства аутоиммунных заболеваний, первоначальный триггер, вызывающий производство аутореактивных лимфоцитов и аутоантител при буллезном пемфигоиде, остается неизвестным. При некоторых других заболеваниях с образованием субэпидермальных пузырей также наблюдаются аутоиммунные реакции относительно ВР180. К таким заболеваниям относятся пемфигоид (или герпес) беременных, рубцующий пемфигоид (или пемфигоид слизистых оболочек), буллезный IgA-зависимый линейный дерматоз и пемфигоидный плоский лишай. Возможно, что эти заболевания имеют некоторые общие с буллезным пемфигоидом иммунопатологические механизмы.
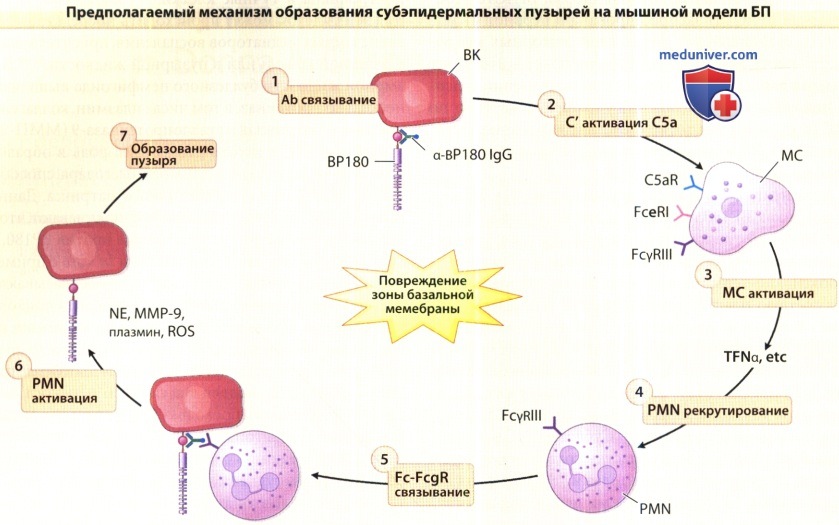
Образование субэпидермальных пузырей — это воспалительный процесс, который состоит из следующих этапов:
1. Анти-ВР180 IgG связывается с патогенным эпитопом антигена ВР180 на поверхности базальных кератиноцитов (ВК);
2. Молекулярное взаимодействие между антигеном ВР180 и анти-ВР180 IgG активирует классический механизм системы комплемента (С');
3. Активация С» приводит к образованию С3а, а С5а вызывает дегрануляцию тучных клеток (МС);
4. TNF-a и другие провоспалительные медиаторы, высвобождаемые тучными клетками рекрутируют нейтрофилы (PMN = полиморфонуклеарные лейкоциты);
5. Инфильтрирующие нейтрофилы связываются с иммунным комплексом ВР180-анти-ВР180 через молекулярное взаимодействие между рецептором III Feγ (FcyRIII) на нейтрофилах и Fc-доменом анти-ВР180 IgG;
6. Взаимодействие между Fc и FcyRIII активирует нейтрофилы (PMNs) к высвобождению нейтрофильной эластазы (NE), желатиназы В (ММР-9), активаторов плазминогена (PAs) и реактивных форм кислорода (ROS);
7. Протеолитические ферменты и ROS совместно разлагают ВР180 и другие белки внеклеточного матрикса, что приводит к образованию субэпидермальных пузырей.
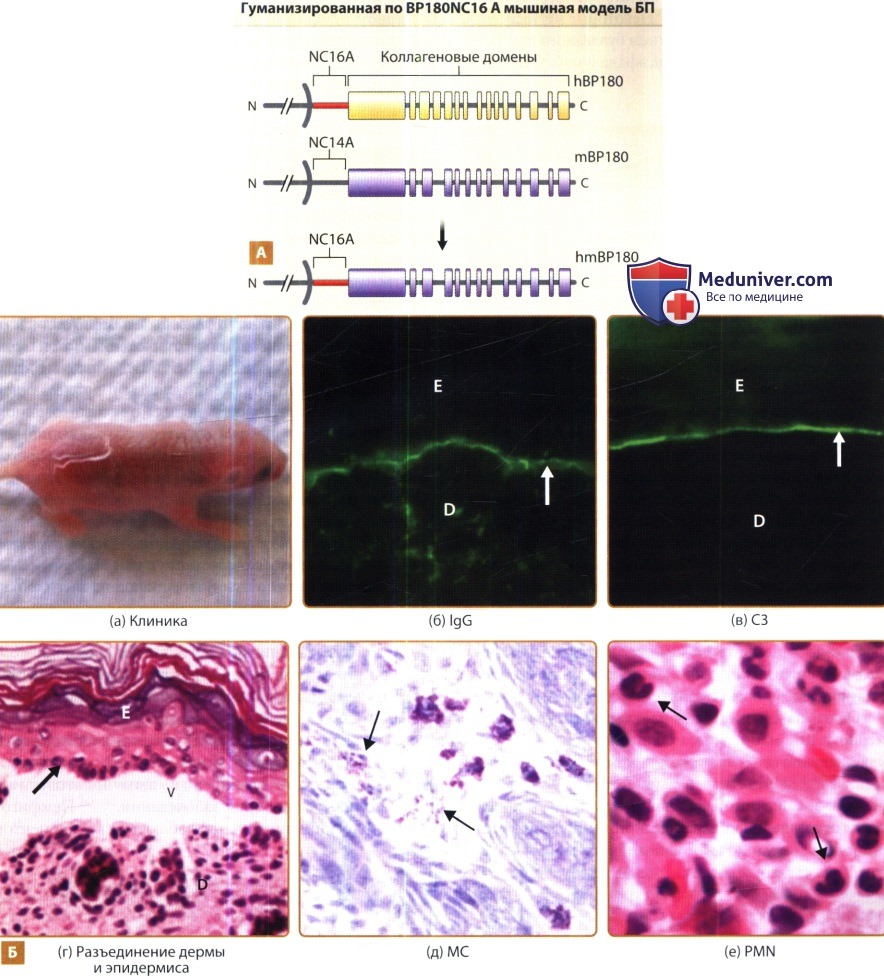
А. ВР180 человека (верхняя панель) представляет собой трансмембранный белок кератиноцитов.
Он содержит один трансмембранный домен. Внеклеточный участок состоит из 15 коллагеновых доменов с перерывами (желтые планки) и 16 неколлагеновых доменов (черные линии).
Домен NC16A (красная линия) содержит иммунодоминантные эпитопы, которые распознаются аутоантителами БП.
Внеклеточный участок мышиного ВР180 (средняя панель) содержит 13 коллагеновых доменов (синие планки) и 14 неколлагеновых доменов (черные линии).
У мышей с гуманизированным BP180NC16A мышиный домен BP180NC14A был заменен доменом человека NC16A (нижняя панель).
Б. У неонатальных мышей с NC16A при внутридермальном введении специфических IgG-аутоантител BP180NC16A развивались клинические пузыри (а).
Прямая ИФ показала отложения в зоне базальной мембраны человеческого IgG (б) и мышиного С3 (в).
Гистологическое исследование срезов очаговой кожи показало разъединение дермы и эпидермиса (г).
Исследование кожных срезов после окрашивания толуидиновым синим выявило дегранулирующие тучные клетки (МС) (д).
Окрашивание гематоксилином/эозином (Н/Е) показало инфильтрирующие нейтрофилы (PMN) в верхних слоях дермы (увеличение х400) (е).
Е = эпидермис; D = дерма; V = везикула; стрелки на панелях б-г = базальные кератиноциты.
- Рекомендуем далее ознакомиться со статьей "Симптомы и клиника буллезного пемфигоида"
Оглавление темы "Буллезный пемфигоид.":
