Схема развития воспаления
Воспаление — это защитная реакция организма и его тканей в ответ на повреждение. Цель этой реакции заключается в восстановлении поврежденной ткани или ограничении этого повреждения, а также в удалении повреждающего фактора, например бактерий или чужеродных частиц.
Причинами воспаления могут быть: микроорганизмы: бактерии, вирусы, грибы или паразиты; чужеродные частицы (чужеродные белки, например пыльца; частицы асбеста или кристаллы кремния); разрушение ткани с образованием продуктов ее распада, например, в результате механических травм (порезов, колотых ран, ссадин или попадания инородных тел), действия химических веществ, таких как кислоты или щелочи, физических факторов (холода, тепла, излучения [ультрафиолетового, рентгеновского, радиоактивного]); эндогенные причины — распад опухолевых клеток, кровоизлияния, аутоиммунные реакции или кристаллы веществ, выпадающих в осадок в организме (мочевая кислота, оксалаты кальция, фосфаты кальция и холестерин).
Острое воспаление само по себе проявляется как местная реакция с симптомами, известными еще с античных времен: боль (dolor), припухлость (tumor), покраснение (rubor) и жар (calor). Кроме того, воспаление может сопровождаться системными реакциями (ответ острой фазы воспаления).
Примером острой воспалительной реакции служит быстрая активация тучных клеток прроисходящая в тканях или их аналогов в крови, а также базофильных лейкоцитов, или базофилов. По этому механизму развиваются в основном реакции гиперчувствительности I типа.
Если организм ранее контактировал с антигеном (при развитии гиперчувствительности антиген называют аллергеном), например содержащимся в яде пчел, В-клетки уже будут сенсибилизированы к этому аллергену (в кооперации с Тh2-клетками). Образовавшиеся из В-клеток плазматические клетки выделяют IgE, который соединяется с Fcε-рецепторами тучных клеток. При повторном контакте с антигеном вновь образованные IgE связываются с антигеном своими Fab-фрагментами. Это играет важную роль для последующего взаимодействия тучных клеток с аллергеном, объединенным с несколькими молекулами IgE (связь с антителом), причем особенно эффективны крупные антигены, которые способны повторно взаимодействовать с различными частями молекул (поливалентность) (например, паразиты с несколькими связанными гаптенами).
Образование связи между антителами и антигеном запускает процесс высвобождения из тучных клеток вторичных мессенджеров (цГМФ, инозитолфосфата, ионов Са2+), которые вызывают быструю дегрануляцию тучных клеток, т. е. экзоцитоз с высвобождением медиаторов воспаления и хемокинов, депонированных в этих гранулах (гистамин. IL-8, эотаксин, фактор хемотаксиса нейтрофилов [NCF] и др.). Ионы Са2+ также активируют фосфолипазу А2, которая высвобождает из фосфолипидов клеточной мембраны арахидоновую кислоту. Это вещество служит субстратом для других важных медиаторов воспаления, а именно простагландинов (Е2 и др.) и лейкотрие-нов (С4, D4 и Е4, которые вместе называются медленно реагирующей субстанцией анафилаксии [SRS-A], а также лейкотриен В4). Из мембраны тучных клеток выделяется еще один важный медиатор воспаления и вещество, участвующее в реакциях гемостаза, -эфир фосфолипидной природы — фактор активации тромбоцитов (PAF).
При дальнейшем развитии воспалительной реакции из нейтрофилов, эозинофилов и макрофагов выделяются лейкотриены и PAF. Последний также высвобождается из тромбоцитов. Это усиливает воспалительную реакцию и обусловливает вовлечение системы гемостаза в процесс воспаления. Названные клетки вовлекаются в очаг воспаления хемокинами (хемотаксис). Эотаксин, PAF и лейкотриен В4 действуют на эозинофилы (и Th2-клетки) подобно хемоаттрактантам. В силу того, что PAF активирует и тучные клетки, эти два типа клеток действуют совместно.
Нейтрофилы и моноциты вовлекаются в очаг воспаления лейкотриеном В4, компонентом комплемента С5a, NCF, TNF-a, IL-1, И-4и некоторыми хемокинами, например IL-8.
Гистамин, PAF, лейкотриены С4, D4 и Е4 действуют совместно с остальными медиаторами (PGE2, брадикинином) и вызывают: 1) расширение сосудов (артериол), 2) повышение парацеллюлярной проницаемости эндотелия и 3) стимуляцию ноцицепторов.
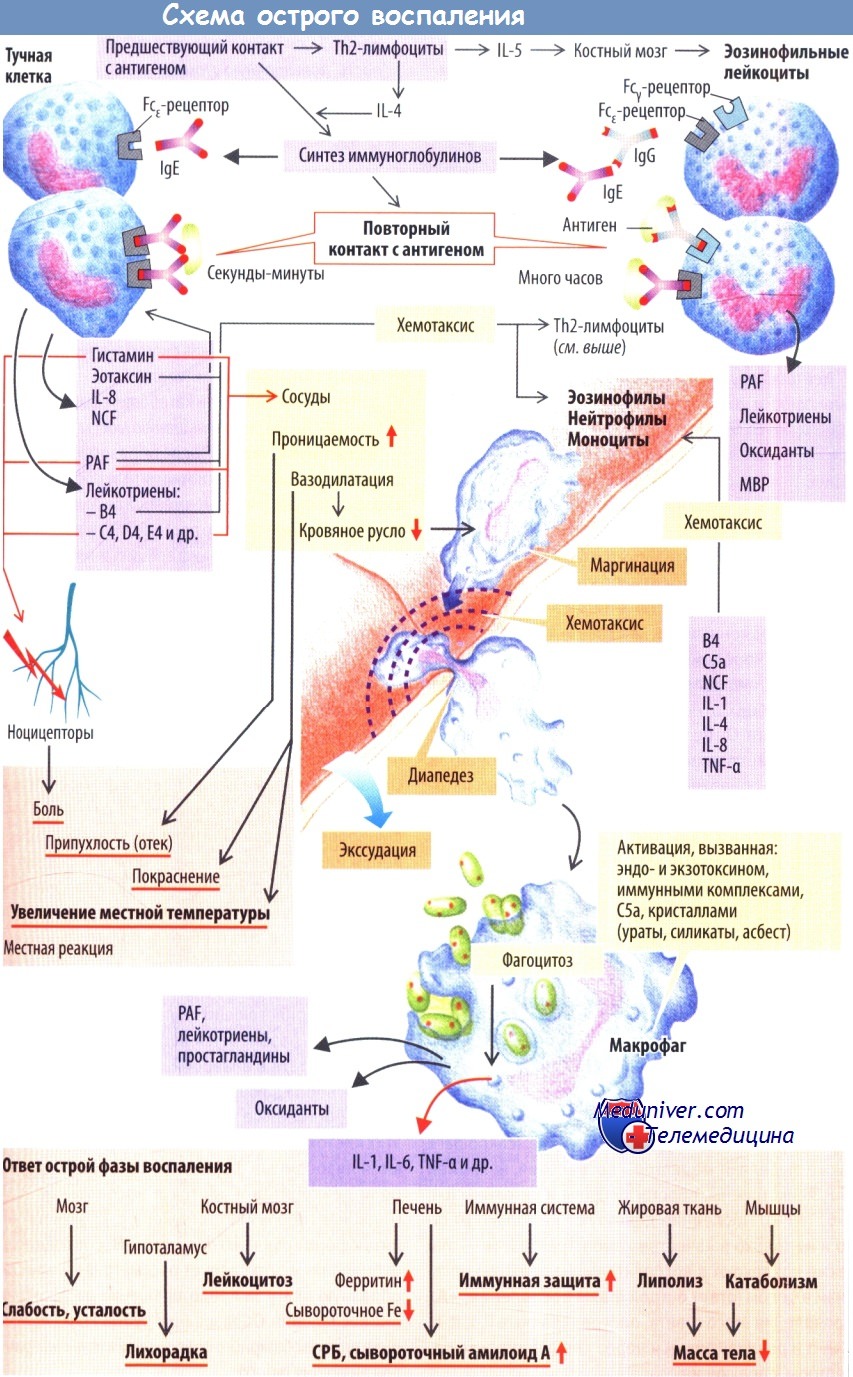
Расширение сосудов обусловливает покраснение воспаленной ткани и повышение ее температуры. Вазодилатация также приводит к замедлению кровотока, что дает возможность лейкоцитам после воздействия хемоаттрактантов перемещаться из осевого потока ближе к эндотелию. Эндотелиальные клетки, активированные в очаге воспаления различными веществами, в т. ч. IL-4 (из Th2-клеток), экспрессируют на своей поверхности, обращенной в просвет сосуда, селектины. Эти селектины, по сути являющиеся молекулами клеточной адгезии, вызывают перемещение лейкоцитов по поверхности эндотелия и активируют другие молекулы адгезии (интегрины, ICAM-1, VCAM).
Это дает возможность лейкоцитам прикрепляться к сосудистой стенке (маргинация). Увеличение проницаемости эндотелия (потеря контактов между эндотелиальными клетками) позволяет лейкоцитам выходить из сосудов во внесосудистое пространство (диапедез). Кроме того, в интерстициальное пространство выходит жидкость, содержащая большое количество белков (воспалительный экссудат), вследствие чего развивается отек. В тяжелых случаях из сосудов выходят даже эритроциты (геморрагическое воспаление). Наконец, возникает боль, вследствие которой человек осознает наличие патологического процесса и рефлекторно стремится защитить воспаленный участок (например, конечность).
Нейтрофилы, мигрировавшие в очаг воспаления, и макрофаги, дифференцировавшиеся из мигрировавших в этот очаг моноцитов, начинают фагоцитировать патогены, вызвавшие воспаление, и переваривать их с помощью лизосом. «Аппетит» фагоцитов усиливается после опсонизации патогенов IgG или компонентом комплемента СЗb.
При воспалении активируется также система комплемента. Это происходит либо классическим путем в присутствии комплексов антиген — антитело, либо более медленным, так называемым альтернативным путем через менее специфичное связывание с клетками, инфицированными бактериями или вирусами. В обоих случаях образуется С3b-компонент комплемента. Он не только опсонизирует антигены, ной вызывает полимеризацию других компонентов (С5—С9) на поверхности клеток, атакованных патогеном, с образованием мембраноатакующего комплекса, который запускает лизис патогена. Помимо этого система комплемента способна разрушать частицы вирусов и комплексы антиген — антитело. Побочные продукты активации системы комплемента (СЗа, С4а и С5а, так называемые анафилаксины) действуют в качестве хемоаттрактантов и активируют макрофаги.
Макрофаги активируются главным образом экзо- и эндотоксинами патогенов, комплексами антиген — антитело, С5а, различными кристаллами, а также при фагоцитозе. В результате их активации высвобождаются оксиданты, такие как О2-, ОН-, О2 и Н2О2, повреждающие патогены. Макрофаги также выделяют медиаторы воспаления, например PAF, лейкотриены, простагландины и цитокины IL-1, IL-6, TNF-α. Последние действуют не только мест-но и не только в качестве хемоаттрактантов — они также вовлекают в воспалительную реакцию организм в целом (ответ острой фазы воспаления). Проявления этого ответа, опосредованные IL-1, IL-6, TNF-a и реализующиеся через специфические рецепторы, следующие:
- воздействие на нейроны, ответственные за медленный сон, вызывает заторможенность, сонливость, повышенную утомляемость, усталость; - установочная точка терморегуляции смещается на более высокий уровень, развивается лихорадка;
- стимулируется высвобождение лейкоцитов из костного мозга с развитием лейкоцитоза; стимулируется функция печени, что проявляется усилением захвата гепатоцитами железа и образованием так называемых белков острой фазы (С-реактивный белок [СРБ] и сывороточный амилоид А);
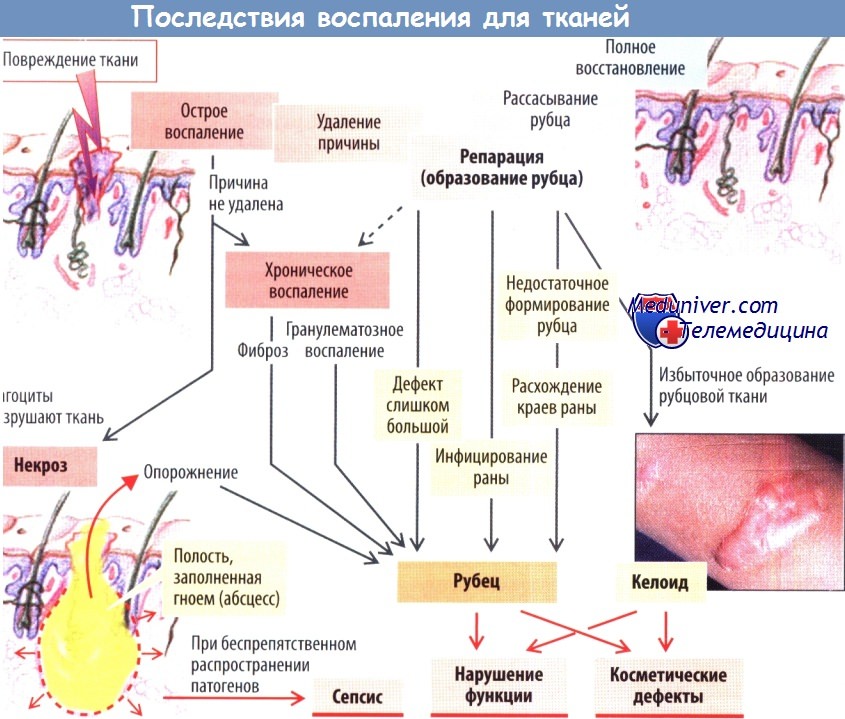
- стимулируется иммунная система (в частности, усиливается выработка антител); запускаются липолиз и катаболические процессы, способствующие уменьшению массы тела. Заживление ткани. После образования грануляционной ткани, богатой клетками (макрофагами и др.) и характеризующейся выраженной васкуляризацией, тромбоцитарный фактор роста (PDGF) и другие медиаторы стимулируют пролиферацию и миграцию фибробластов.
Они продуцируют гликозаминогликаны, которые набухают и откладываются в ткани в виде коллагеновых волокон. Кроме того, образуются новые волокно коллагена, благодаря сокращению которых сближаются края раны.
В итоге в месте повреждения коллагеновые волокна (рубец) замещаются новой тканью (от лат. restitutio ad integrum — полное восстановление). Однако такое замещение поврежденной ткани характерно лишь для небольших по размеру и неинфицированных ран. При наличии вторичного воспаления (обусловленного наличием инородных тел в ране или ее инфицированием) заживление раны затягивается во времени, усиливается защитный ответ макрофагов. Это требует дополнительной энергии (повышение температуры). Синхронно активированная система гемостаза способствует окклюзии сосудов в прилегающих областях; в результате недостатка О2 развивается дефицит АТФ; из-за накопления лактата в анаэробных условиях снижается pH. Высвобождающиеся оксиданты также повреждают собственные клетки организма.
При гибели этих клеток во внеклеточное пространство выделяются лизосомные ферменты, способствующие гибели лейкоцитов и клеток в воспаленной ткани. Подобная гибель клеток (некроз) может приводить к формированию абсцесса с последующий рубцеванием, что следует рассматривать как своеобразную плату за предотвращение распространения воспаления. Образование рубца также происходит в случае обширного повреждения ткани (например, при зияющих ранах).
Нарушения процесса заживления ран возникают в случае дисбаланса между процессами воспаления и заживления (при хроническом воспалении, например при бронхите курильщика или в случае алкогольного поражения печени). Образование слишком больших количеств коллагена вызывает фиброзирующее воспаление (в частности при циррозе печени). В случаях с избыточен образованием грануляционной ткани развивается гранулематозное воспаление (при туберкулезе, также при воспалении, вызванном инородными телами).
При дефектах качественных характеристик рубцовой тккани (например, в случае нарушения процесса синтеза коллагена поддействием глюкокортикоидов и образования поперечныхсвязей между волокнами коллагена при дефиците витамина С) локальное напряжение в области раны может способствовать ее повторному открытию (например, расхождение краев раны после абдоминальных хирургических вмешательств). Рубцы в области лица оставляют косметические дефекты, особенно при избыточном рубцевании (келоидные рубцы). В некоторых случаях рубцы могут вызывать серьезные функциональные расстройства: рубцы роговицы сопровождаются расстройствами зрения, рубцы в области клапанов сердца вызывают стенозы или регургитацию крови, рубцы в брюшной полости нередко бывают причиной спаечной болезни.
Если локализовать воспаление, вызванное патогенами, невозможно, они распространяются по всему организму, обычно по лимфатической системе, с развитием сепсиса. Такое происходит, например, при внезапном попадании патогенов на большую поверхность брюшины (при разрыве толстой кишки, вскрытии абсцесса).
- Рекомендуем ознакомиться со следующей статьей "Схема развития аллергии - рекции гиперчувствительности первого типа"
Оглавление темы "Патофизиология в схемах":- Схема развития мегалобластной анемии (В12-дефицитной анемии, анемии дефицита фолиевой кислоты)
- Схема развития анемии при нарушении синтеза гемоглобина
- Схема развития железодефицитной анемии
- Схема развития гемолитической анемии
- Схема организации иммунной системы человека
- Схема развития воспаления
- Схема развития аллергии - рекции гиперчувствительности первого типа
- Схема развития аллергической рекции второго типа (цитотоксического)
- Схема развития аллергической рекции третьего типа (иммунокомплексного)
- Схема развития аллергической рекции четвертого типа (замедленного)

