Маркеры полиморфизма ДНК и их молекулярная диагностика
Определение мутаций описанными методами возможно только в тех случаях, когда известен ген, отвечающий за наследственное заболевание, и расшифрована последовательность нуклеотидов в этом гене. В случаях с несколькими заболеваниями, которые имеют генетическую природу, включая некоторые распространенные болезни, прямая генетическая диагностика невозможна либо из-за того, что ген пока неизвестен, либо в связи с тем, что болезнь является многофакторной и в патологический процесс вовлечен не один ген.
В таких случаях для локализации интересующих хромосомных областей используют дополнительные маркеры, известные как маркерные локусы.
Анализ основан на их сцеплении с одним или несколькими генами, предположительно задействованными в развитии заболевания. При анализе сцепления (линкерном анализе, косвенном анализе) оценивают эти маркерные локусы у членов семьи, которые имеют симптомы заболевания или интересующий признак, при этом предполагается, что маркерный локус, расположенный очень близко к аллелю заболевания, передается потомству (равновесие сцепления).
Со временем становится возможным определить «гаплотип заболевания» на основании списка маркерных локусов, передающихся вместе с аллелями, предположительно вызывающими заболевание. В конечном счете анализ сцепления помогает определить локализацию и клонировать аллель заболевания. Маркерные локусы, используемые в анализе сцепления, представляют собой возникающие естественным путем вариации последовательностей ДНК, известные как полиморфизмы. Наибольшую ценность для анализа сцепления представляют два вида генетических полиморфизмов: SNP и полиморфизмы длины повторов.
SNP встречаются с частотой приблизительно 1 нуклеотид на каждую 1000 пар оснований длины и распространены по всему геному (например, в экзонах и интронах и в регуляторных последовательностях). SNP могут служить и физическим ориентиром, и генетическим маркером, передачу которого от родителя к потомству можно проследить. В связи с тем что SNP распространены по всему геному и являются относительно стабильными структурами, их используют для анализа сцепления с целью определения гаплотипа заболевания.
ДНК человека содержит короткие повторяющиеся последовательности ДНК, представляющие собой полиморфизмы длины повторов. По длине эти полиморфизмы можно разделить на две группы: микросателлиты и минисателлиты. Микросателлиты характеризуются длиной не более 1 килобазы и повторами 26 пар нуклеотидов. Минисателлиты длиннее (1-3 кб) и содержат повторы большего размера (15-70 пар нуклеотидов). Необходимо отметить, что количество повторов как в микросателлитах, так и в минисателлитах может значительно варьировать внутри одной популяции, поэтому эти участки ДНК можно эффективно использовать для генетической идентификации, необходимой для проведения анализа сцепления.
Микросателлиты и минисателлиты небольшого размера легко отличить, если использовать для ПЦР праймеры, прикрепляющиеся к краю области повтора. Обратите внимание, что продукты ПЦР трех разных аллелей имеют различную длину (отсюда название «полиморфизм длины повторов»).
Анализ сцепления полезен в антенатальном периоде и до появления симптомов для диагностики таких заболеваний, как болезнь Хантингтона и аутосомно-доминантный поликистоз почек, хотя для каждого из этих заболеваний вызывающий его ген известен. Обычно, когда известен ген, связанный с заболеванием, методом выбора для определения мутаций является прямое секвенирование.
Однако если заболевание развивается вследствие нескольких мутаций в конкретном гене или если секвенирование гена нецелесообразно либо дало отрицательный результат на наличие мутации при явных клинических признаках заболевания, используют анализ сцепления. На рисунке ниже показано, как можно использовать микросателлитные полиморфизмы для анализа наследования аутосомно-доминантного поликистоза почек. В этом случае аллель С, который дает более длинный продукт ПЦР, чем аллели А или В, содержит ассоциированный с болезнью ген. Таким образом, все носители аллеля С страдают этим заболеванием.
Определение генетических полиморфизмов применяют и в других областях медицины, в т.ч. для определения связи и идентичности трансплантации, в генетических исследованиях злокачественных опухолей, тесте на отцовство и судебной медицине. Поскольку микросателлитные маркеры встречаются по всему геному и часто содержат полиморфизмы, они незаменимы при необходимости отличить одного человека от другого или проследить передачу маркера от родителя к потомству.
Наборы микросателлитных маркеров для анализа с помощью ПЦР хорошо отрегулированы, и сейчас их широко применяют для определения отцовства и при криминальных расследованиях. В связи с тем что ПЦР можно проводить даже на разложившемся биологическом материале, ДНК-технологии незаменимы в судебной медицине. Такие же методы применяют для выявления и количественной оценки химеризма трансплантата при аллогенной пересадке костного мозга.
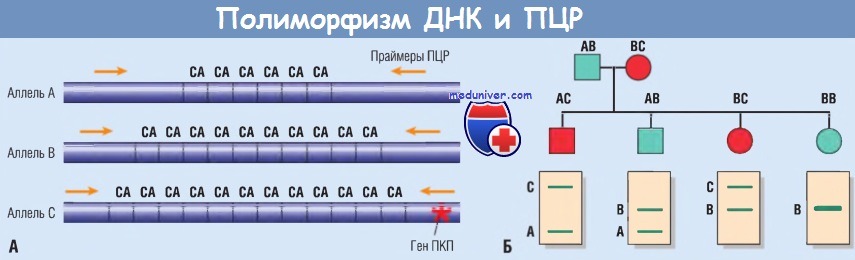
Три аллеля дают продукты различной длины, что позволяет определить, на какой хромосоме они располагаются.
В этом примере аллель С связан с мутацией, отвечающей за развитие аутосомно-доминантного поликистоза почек (ПКП).
(Б) Применение полимеразной цепной реакции (ПЦР) для выявления потомства, носящего связанный с болезнью ген (красные символы), проиллюстрировано на гипотетической родословной.
Мужчины обозначены квадратами, женщины — кругами.
Полиморфизмы и расширенный геномный анализ
Как уже упоминалось, анализ сцепления с использованием генетического материала больного и членов его семьи полезен для выявления генов с большими эффектами и высокой пенетрантностью, которые обычно приводят к развитию менделевских заболеваний. Попытки проведения аналогичного анализа для определения многофакторных заболеваний оказались безуспешными, т.к. исследование сцепления традиционными методами не имеет статистической силы для выявления генов с малыми эффектами и низкой пенетрантностью, которые обычно вносят вклад в развитие комплексных заболеваний.
Эти ограничения были сняты GWAS — мощным методом расширенного геномного анализа, используемым для идентификации генетических вариантов, которые ассоциируются с повышенным риском развития определенного заболевания. Такие варианты сами по себе могут быть причинами развития заболевания или находиться в состоянии неравновесного сцепления с другими генетическими вариантами, отвечающими за повышенный риск. При GWAS весь геном большой когорты пациентов с заболеваниями или без них (а не семей) анализируют на наличие генетических вариантов или полиморфизмов, которые чаще встречаются у больных людей. Так выявляют геномные области, которые содержат вариантный ген или гены, отвечающие за предрасположенность к заболеванию.
Такой вариантный ген в выявленной области анализируют как ген-кандидат, причем ген выбирают на основании того, как тесно он ассоциируется с заболеванием и насколько вероятно, что его биологические функции связаны с развитием изучаемого заболевания. Например, вариантный ген, продукт которого регулирует тонус клеток гладких мышц сосудов (скажем, ангиотензиноген), с большой вероятностью влияет на риск развития гипертензии.
Как оказалось, некоторые гены связаны с конкретными заболеваниями, что ранее и не предполагали. Такие сюрпризы — одно из преимуществ GWAS.
Появлению GWAS способствовали два крупных технологических прорыва. Первый — завершение проекта НарМар, который предоставил более полную картину неравновесия сцепления в трех основных этнических группах на основании полногеномного картирования SNP. Теперь есть возможность разделить весь геном человека на блоки (известные как гаплотипы), содержащие различное количество смежных SNP на одной и той же хромосоме, которые находятся в состоянии неравновесного сцепления и, таким образом, наследуются вместе в виде кластера.
Теперь вместо того, чтобы изучать отдельные SNP в геноме человека, возможно получить сопоставимую информацию об общей ДНК путем анализа общих гаплотипов, используя один или небольшое количество SNP, которые идентифицируют конкретный гаплотип. Вторым важным открытием стало появление технологии SNP-чипов высокой плотности, что дало возможность относительно недорого генотипировать от сотни тысяч до миллиона SNP одновременно.
На рисунке ниже показано, каким образом можно использовать общедоступную информацию НарМар для создания SNP-чипов, с помощью которых можно беспристрастно анализировать полногеномные гаплотипы. ДНК лиц с определенным заболеванием (например, гипертензией) анализируют с использованием SNP-чипов на определенные гаплотипы, наиболее распространенные среди индивидов с этим признаком по сравнению с лицами без него (контроль). Далее, используя подход генов-кандидатов, определяют локализацию гена (и в некоторых случаях выявляют функциональный полиморфизм внутри этого гена), ассоциирующегося с заболеванием.
GWAS не только пролило свет на некоторые из наиболее распространенных болезней, в т.ч. сахарный диабет, астму, гипертензию, болезнь коронарных артерий, шизофрению и другие психиатрические заболевания, но и способствовала идентификации генетических локусов, которые модулируют распространенные количественные и качественные признаки, например рост, массу тела, цвет волос и глаз, плотность костей. Обновление каталога GWAS, содержащего более 200 результатов и продолжающего пополняться, осуществляет National Human Genome Research Institute. Значение GWAS усиливается уже за счет того, что за очень короткий срок было выявлено около десятка генов, способствующих увеличению риска развития сахарного диабета типа II, в частности гена TCF7L2, который оказался очень сильным геном-кандидатом.
Учитывая стабильное снижение цен на проведение генотипирования на SNP, которое может отнести пациента к группе с угрозой развития многих многофакторных заболеваний в течение жизни, существуют серьезные опасения со стороны биомедицинского сообщества, что такая информация может быть использована для дискриминации со стороны работодателей или учреждений здравоохранения. В 2008 г. в США был принят закон, запрещающий дискриминацию на основании набора генов человека.
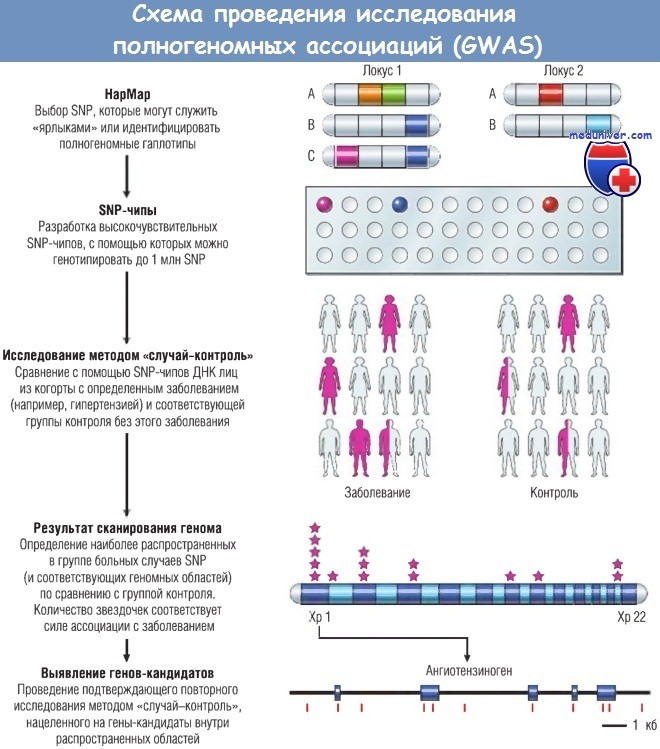
На основании общедоступных данных НарМар геном человека делят на гаплотипы (области ДНК, наследуемые блоками),
каждый из которых идентифицируется на основании одного или нескольких «ярлыковых» однонуклеотидных полиморфизмов (SNP), специфических для данного гаплотипа.
В данном примере локус 1 содержит три гаплотипа, которые определяются тремя различными комбинациями SNP;
на рисунке белым цветом обозначена наиболее распространенная нормальная последовательность и каждый цвет обозначает отдельный SNP.
Таким образом, гаплотипы можно различить между собой, выявив только синий или фиолетовый «ярлыковый» SNP.
На основании этого для выявления SNP были разработаны чипы высокой плотности, содержащие эти «ярлыковые» SNP, позволяющие объективно оценить гаплотипы в здоровой популяции и популяции с заболеванием в масштабе всего генома.
Необходимо отметить, что под «заболеванием» здесь понимается любой определенный фенотип — как реально существующее заболевание, например гипертензия, так и любой качественный признак (цвет волос или глаз).
Далее ДНК, полученную от двух когорт, анализируют на наличие повышенной распространенности SNP в «болеющей» популяции (в «случаях») и сравнивают с контролем — такой метод исследования получил название «случай-контроль».
Наиболее значимые области генома затем исследуют на наличие генов-кандидатов. В данном примере в поисках локусов, ассоциированных с гипертензией, был выявлен ангиотензиноген, располагающийся на 1-й хромосоме, продукт которого регулирует тонус клеток гладких мышц сосудов. На последнем этапе проводят повторное исследование методом «случай-контроль», при котором используемый SNP располагается непосредственно внутри интересующего гена.
На этом этапе подтверждается или опровергается связь с заболеванием (что часто бывает при анализе популяции, отличной от той, на которой проводили первичное GWAS). В этом примере отдельные SNP в гене ангиотензиногена обозначены красными вертикальными полосками, именно эти SNP будут анализировать на втором этапе исследования методом «случай-контроль». ДНК — дезоксирибонуклеиновая кислота; Хр — хромосома.
- Рекомендуем ознакомиться со следующей статьей "Методы молекулярного анализа геномных изменений"
Оглавление темы "Иммунная система":- Возможности ПЦР и методы оценки изменения последовательности ДНК
- Маркеры полиморфизма ДНК и их молекулярная диагностика
- Методы молекулярного анализа геномных изменений
- Эпигенетика и эпигенетические изменения
- Методы анализа РНК (рибонуклеиновой кислоты)
- Врожденный иммунитет и его характеристика
- Приобретенный иммунитет и его характеристика
- Клетки иммунной системы
- Органы иммунной системы
- Молекулы MHC - система презентации пептидов при приобретенном иммунном ответе

