Возможности ПЦР и методы оценки изменения последовательности ДНК
Анализ с помощью ПЦР, включающий экспоненциальную амплификацию ДНК, совершил переворот в молекулярной биологии, и сейчас его широко используют для молекулярной диагностики болезней человека. В результате применения соответствующих полимераз и температурных циклов целевая ДНК размножается с образованием миллионов копий последовательности ДНК, находящейся между двумя праймерами.
Определение аномальной последовательности в дальнейшем можно проводить различным образом. Прямое выявление изменения последовательности ДНК — наиболее простой метод.
а) Прямое выявление изменений последовательности ДНК путем секвенирования
ДНК можно секвенировать и получить расшифровку последовательности нуклеотидов, а потом при сравнении с нормальной последовательностью ДНК (ДНК дикого типа) выявить мутации. Доступность дидеок-синуклеотидного секвенирования Сандера и автоматизированного капиллярного электрофореза позволяет рутинно секвенировать тысячи пар нуклеотидов геномной ДНК в течение нескольких часов. К настоящему моменту известны сотни генов, мутации в которых приводят к развитию менделевских заболеваний; в большинстве случаев возможна постановка точного диагноза путем прямого секвенирования.
Некоторые заболевания, чаще всего с рецессивным механизмом наследования, связаны с ограниченным количеством возможных мутаций — примером может служить кистозный фиброз. При многих других заболеваниях, особенно с доминантным механизмом наследования, мутации могут располагаться в любой области гена.
Трудности секвенирования ДНК для диагностики этих заболеваний связаны с трудоемкостью и дороговизной анализа таких больших генов. Например, ген, поражаемый при миодистрофии Дюшенна, содержит 79 экзонов, а ген FBN1, подвергающийся мутации при синдроме Марфана, — 65 экзонов; секвенирование всей последовательности этих генов может быть чрезвычайно затратным методом, учитывая современную методологию. К другим трудностям относят выявление изменений последовательности ДНК, значимость которых неизвестна и роль в патогенезе не подтверждена в связи с отсутствием функциональных данных.
Ситуация, однако, меняется с невероятной быстротой. Стремительно развивающиеся технологии сейчас позволяют проводить масштабные анализы последовательности герминативной ДНК и обеспечить в ближайшем будущем возможность рутинного секвенирования всего генома человека. Одним из методов для оценки последовательности большого количества генов или их частей является использование генных чипов (микрочипов). Короткие последовательности ДНК (олигонуклеотиды), комплементарные последовательности дикого типа и известным мутациям, распределяются на генном чипе в смежные ячейки, и тестируемая ДНК гибридизуется с чипами.
Перед гибридизацией пробы метят флуоресцентными красителями. Наиболее сильную гибридизацию (а следовательно, и флуоресцентный сигнал) дают те олигонуклеотиды, которые комплементарны последовательности дикого типа без мутаций (при наличии мутации гибридизация будет происходить с комплементарным мутантным олигонуклеотидом). Компьютерные программы могут очень быстро «декодировать» последовательность ДНК, состоящую из сотен тысяч нуклеотидных пар, по характеру флуоресцентного сигнала при гибридизации на чипе и определять потенциальные мутации. Наиболее захватывающим достижением к настоящему моменту является технология, называемая секвенированием нового поколения, которая заключается в проведении ПЦР в масляной эмульсии.
Такой метод позволяет проводить более миллиона отдельных ПЦР одновременно. В настоящее время это еще очень дорогой метод, но он позволяет секвенировать более 1 млрд нуклеотидов (1/3 генома человека) за 1 действие. Сейчас ученые в области биоинформатики пытаются устранить трудности анализа, связанные с таким количеством данных.
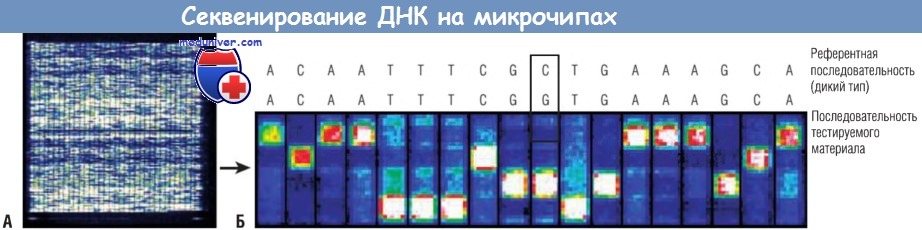
(А) Цифровое сканирование генного чипа. По размерам он не больше пятицентовой монеты, однако с его помощью возможно секвенировать тысячи пар оснований ДНК.
Микрочипы с высокой пропускной способностью используют для секвенирования целых микроорганизмов (например, вирусов), органелл (например, митохондрий) и хромосом человека.
(Б) Изображение с высоким разрешением генного чипа иллюстрирует характер гибридизации, соотнесенный с расшифрованной последовательностью ДНК.
Обычно с помощью компьютерного алгоритма в течение нескольких минут удается превратить индивидуальный паттерн гибридизации со всего чипа в реальную информацию о последовательности
(ранее технологии традиционного секвенирования позволяли выполнить такой анализ в течение нескольких дней и даже недель). Как отмечено на схеме, выявлена мутация С=>G.
б) Выявление изменений последовательности ДНК непрямыми методами
Существует большое количество молекулярных технологий, которые позволяют выявить мутации в ДНК без прямого секвенирования:
- ДНК можно расщепить ферментами, известными как ферменты рестрикции, которые распознают и разрезают ДНК в областях со специфическими последовательностями. Если известно, что определенная мутация поражает сайт рестрикции, то амплифицированная ДНК может быть расщеплена. В результате наличие мутантного и нормального аллелей приводит к образованию продуктов разной длины, что на поверхности агарозного геля при электрофорезе выглядит в виде различных полос.
Этот метод позволяет проводить гораздо меньше исследований, чем автоматизированное или основанное на микрочипах секвенирование, и полезен в тех ситуациях, когда мутация происходит всегда в определенной позиции нуклеотидной цепи;
- другим подходом для определения мутаций в специфической нуклеотидной позиции (например, мутации в 12-м кодоне в KRAS-онкогене, при которой глицин [GGT] превращается в аспарагиновую кислоту [GAT]) является добавление меченных флуоресцентными метками нуклеотидов С и Т в смесь для ПЦР, при этом меченые нуклеотиды комплементарны либо нормальной (G), либо мутантной (А) последовательности соответственно. Поскольку эти два нуклеотида помечены различными флуорофорами, продукт ПЦР может излучать флуоресценцию либо одного, либо другого цвета в зависимости от того, какой из нуклеотидов (С или Т) участвует в процессе экстензии праймера.
Преимуществом стратегии аллель-специфической экстензии является то, что она может выявлять наличие мутантной ДНК даже в гетерогенной смеси нормальных и патологических клеток (например, в препаратах, полученных от больных с подозрением на наличие злокачественного новообразования);
- существует множество основанных на ПЦР технологий, в которых используют флуоресцентные индикаторы, позволяющие выявлять мутации в режиме реального времени (т.е. во время экспоненциальной фазы амплификации ДНК). Эти методы значительно снизили время, затрачиваемое на выявление мутаций, т.к. отсутствуют этапы расщепления ферментом рестрикции и электрофореза традиционной ПЦР;
- анализ с помощью ПЦР также применяют для выявления мутаций, изменяющих длину ДНК (например, делеций или экспансий). Как отмечалось ранее, некоторые заболевания, например синдром ломкой Х-хромосомы, ассоциируются с тринуклеотидными повторами. На рисунке проиллюстрирован процесс выявления таких мутаций с помощью ПЦР. Два праймера, присоединяющиеся к последовательности нуклеотидов на 5'-конце гена FMR1, в котором обнаружены тринуклеотидные повторы, используются для амплификации расположенных между ними последовательностей.
Поскольку возможны большие различия в количестве повторов, размеры продуктов ПЦР, полученных от ДНК здоровых людей и от ДНК больных с премутациями, могут отличаться. Эти различия в размерах выявляют при дифференциальной миграции продуктов амплификации ДНК в геле. К настоящему моменту выявление полной мутации с помощью ПЦР невозможно, т.к. длина пораженного сегмента слишком велика для традиционной ПЦР. В таких случаях для анализа геномной ДНК необходим саузерн-блоттинг (см. «Саузерн-блоттинг» - рекомендуем пользоваться формой поиска по сайту выше).
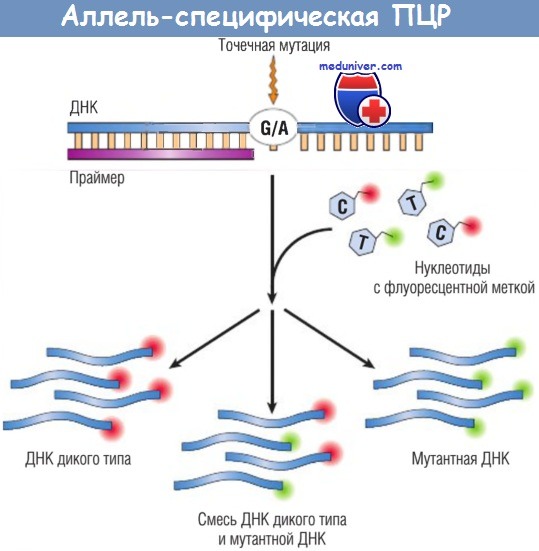
Нуклеотиды, комплементарные мутантным нуклеотидам дикого типа, локализация которых находится под вопросом, метят различными флуорофорами.
Включение меченых нуклеотидов в образующийся продукт ПЦР дает флуоресцентный сигнал различной интенсивности в зависимости от соотношения в материале мутантной ДНК и ДНК дикого типа.
ДНК — дезоксирибонуклеиновая кислота.
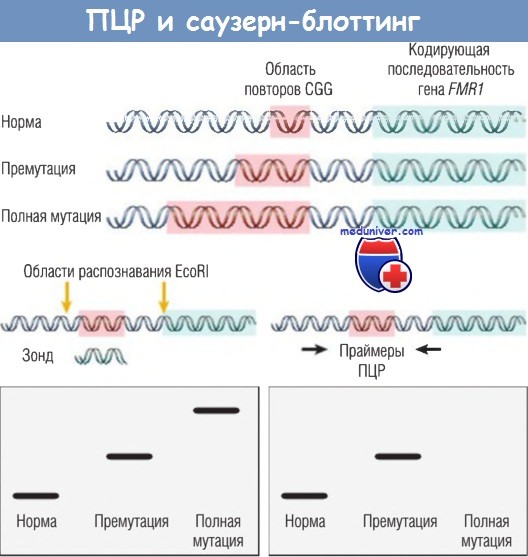
При ПЦР различная длина повторов CGG в норме и при премутации приводит к образованию продуктов разной длины и подвижности.
При полной мутации область между праймерами слишком велика для амплификации при традиционной ПЦР.
При саузерн-блоттинге ДНК обрезается ферментами, которые ограничивают область повторов CGG, а потом зондируется с помощью ДНК, которая связывается с пораженным участком гена.
У здоровых мужчин обнаруживается один небольшой сегмент, у мужчин с премутацией этот сегмент имеет большую молекулярную массу, тогда как при полной мутации выявляется очень крупный (часто диффузный) сегмент.
ДНК — дезоксирибонуклеиновая кислота; ПЦР — полимеразная цепная реакция.
- Рекомендуем ознакомиться со следующей статьей "Маркеры полиморфизма ДНК и их молекулярная диагностика"
Оглавление темы "Иммунная система":- Возможности ПЦР и методы оценки изменения последовательности ДНК
- Маркеры полиморфизма ДНК и их молекулярная диагностика
- Методы молекулярного анализа геномных изменений
- Эпигенетика и эпигенетические изменения
- Методы анализа РНК (рибонуклеиновой кислоты)
- Врожденный иммунитет и его характеристика
- Приобретенный иммунитет и его характеристика
- Клетки иммунной системы
- Органы иммунной системы
- Молекулы MHC - система презентации пептидов при приобретенном иммунном ответе

