Методы молекулярного анализа геномных изменений
Значительное количество генетических заболеваний развивается вследствие крупных делеций, дупликаций или более сложных вариантов реорганизации, которые сложно выявить с помощью методов ПЦР и секвенирования. Такие геномные изменения можно изучать с помощью различных технологий, основанных на гибридизации.
а) Саузерн-блоттинг. Изменения в структуре специфических локусов можно выявить методом саузерн-блоттинга. Этот метод заключается в гибридизации радиомеченых проб, специфических к определенной последовательности геномной ДНК, которую предварительно подвергают расщеплению с помощью ферментов рестрикции и разделяют путем электрофореза в геле.
Обычно проба выявляет у здоровых людей одну основную полосу. Важно отметить, что для этого исследования необходим материал, содержащий нормальную ДНК, чтобы можно было сравнить с исследуемой ДНК. С появлением метода FISH и технологии микрочипов саузерн-блоттинг ушел на второй план, однако до сих пор его используют для выявления заболеваний, вызванных длинными тринуклеотидными экспансиями, в т.ч. синдрома ломкой Х-хромосомы, и для реорганизаций гена клонального Ig при диагностике лимфомы.
Для последней сейчас начали применять методы, основанные на ПЦР.
б) Метод флуоресцентной гибридизации in situ. При методе FISH используют ДНК-зонды, которые выявляют последовательности, специфические для определенных участков хромосом. Частью проекта «Геном человека» было создание архивов искусственных бактериальных хромосом, содержащих весь геном человека. Длина вставок ДНК человека в этих клонах составляет 100-200 тыс. пар нуклеотидов, что и определяет возможность выявления хромосомных изменений методом FISH.
Эти клоны ДНК с флуоресцентной меткой используют на метафазных пластинках или интерфазных ядрах. Зонд присоединяется к комплементарным последовательностям на хромосомах и, таким образом, метит специфическую область на хромосоме, которую можно увидеть с помощью флуоресцентного микроскопа. Отсутствие необходимости в делящихся клетках для проведения FISH особенно ценно в тех случаях, когда нужна экстренная диагностика (например, для принятия решения о лечении пациента с острой миелоидной лейкемией ретиноевой кислотой, которая эффективна только при определенном подтипе хромосомной транслокации, поражающей ген рецептора ретиноевой кислоты).
Такой анализ можно проводить на пренатальном материале (например, на клетках, полученных при амниоцентезе, биопсии ворсин хориона или из пуповинной крови), лимфоцитах периферической крови или даже на архивных срезах ткани. Метод FISH используют для выявления количественных хромосомных нарушений (анеуплоидий); для определения микроделеций или сложных транслокаций, которые не обнаруживаются при рутинном кариотипировании; для анализа генной амплификации (например, ERBB2 при раке молочной железы или N-MYC в нейробластомах); для картирования впервые выделенных генов при определении их локуса на хромосоме. Окрашивание хромосом — один из вариантов метода FISH, при котором используют пробы к целой хромосоме.
Количество хромосом, которые можно выявить с помощью этого метода одновременно, ограничено количеством доступных флуоресцентных красителей, излучающих видимый свет с различными длинами волн. Это ограничение исчезло при внедрении спектрального кариотипировании (также известного как многоцветовая FISH). Используя комбинацию из пяти флуорохромов и соответствующие компьютерные сигналы, можно визуализировать весь геном человека. Возможности этого метода впечатляют.
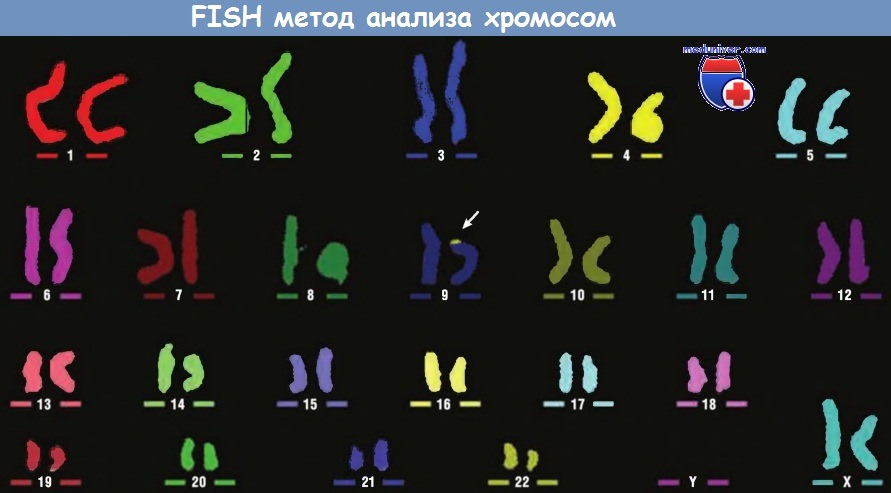
В этом методе используют зонды, меченные 23 смесями из 5 флуорохромов, окрашивающих каждую хромосому в определенный цвет.
Это исследование выявило измененную 9-ю хромосому, малое плечо которой содержит дополнительный материал с 22q (стрелка).
в) Метод сравнительной геномной гибридизации. Для исследования методом FISH необходимо знание одного или нескольких специфических хромосомных участков, которые могут быть повреждены в каждом конкретном случае. Однако методом сравнительной геномной гибридизации (CGH) можно выявить хромосомные аномалии, не зная ничего о нарушениях.
При методе CGH тестируемую ДНК и контрольную (референтную) ДНК метят двумя различными флуоресцентными красителями (наиболее часто Су5 и Су3, которые дают красный и зеленый сигналы соответственно). Затем меченые ДНК подвергают гибридизации на пластинке с пробами ДНК, которые охватывают весь геном человека, располагаясь на одинаковом расстоянии друг от друга; обычно они покрывают 22 аутосомы и X-хромосому. Если вклад обеих ДНК в определенный хромосомный участок равноценен (т.е. тестируемая ДНК является диплоидной), все области генома будут давать желтый сигнал (в результате смешивания равных количеств красного и зеленого красителей).
Однако если в тестируемом материале содержится избыток ДНК на каком-то конкретном участке хромосомы (например, при амплификации), в этой области будет видно усиленное свечение того красителя, которым была помечена исследуемая ДНК. При наличии делеции будет наблюдаться обратная картина, т.е. усиленный сигнал даст контрольная ДНК. С помощью этого метода удается точнее определить локализацию амплификации и делеции в тестируемом материале, иногда с точностью до нескольких тысяч пар нуклеотидов. Микрочипы нового поколения имеют еще большую разрешающую способность (более 100 тыс. проб на чип); сейчас их используют для определения количества аномальных копий при различных заболеваниях — от злокачественных опухолей до аутизма.
Чиповую CGH регулярно используют в случаях умственной отсталости, задержки развития неясной этиологии или у детей с дисморфизмом, у которых кариотипирование не выявило патологии.
Как уже обсуждалось в этой главе, CNV представляют собой недавно открытый источник генетических полиморфизмов, который был обнаружен с помощью чипового CGH. Хотя эти полиморфизмы чрезвычайно интересны для понимания различий в геномах людей, интерпретация полиморфизмов в клинической практике оказывается проблематичной.
При сравнении двух геномов обычно обнаруживается огромное количество CNV, общая длина которых может достигать миллионов пар нуклеотидов. Трудно определить, является ли специфическое изменение доброкачественным полиморфизмом или эта дупликация либо делеция играет ведущую роль в развитии заболевания. Сейчас созданы базы данных CNV, которые помогают определить значимость исследуемой вариации. Другим лимитирующим фактором существующих микрочипов CGH является их неспособность выявлять сбалансированные транслокации, т.к. они характеризуются лишь реорганизацией, утраты или получения новой генетической информации не происходит. Тем не менее чрезвычайная чувствительность молекулярных методов должна способствовать тому, чтобы технологии, аналогичные CGH, вышли на первый план среди других методов геномной диагностики и, возможно, полностью заменили традиционное кариотипирование.
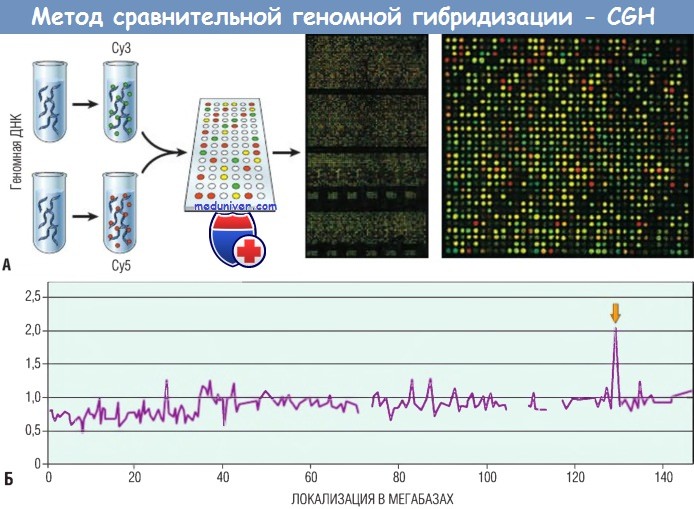
Разрешение наиболее современных доступных тест-систем для проведения исследования методом CGH составляет 200-500 кб.
При большем увеличении выявляются количественные аномалии копий в тестируемом материале (Су5, красный сигнал), включая амплифицированные области (точки с избыточным красным сигналом) и делеции (точки с избыточным зеленым сигналом); желтые точки соответствуют нормальному (диплоидному) количеству копий.
(Б) Сигналы гибридизации оцифровываются и формируют виртуальный кариотип генома тестируемого материала.
В данном примере исследование раковой клеточной линии выявило наличие амплификации в дистальном отделе длинного плеча 8-й хромосомы (стрелка), что обусловливает увеличение количества копий онкогена MYC.
ДНК — дезоксирибонуклеиновая кислота.
- Рекомендуем ознакомиться со следующей статьей "Эпигенетика и эпигенетические изменения"
Оглавление темы "Иммунная система":- Возможности ПЦР и методы оценки изменения последовательности ДНК
- Маркеры полиморфизма ДНК и их молекулярная диагностика
- Методы молекулярного анализа геномных изменений
- Эпигенетика и эпигенетические изменения
- Методы анализа РНК (рибонуклеиновой кислоты)
- Врожденный иммунитет и его характеристика
- Приобретенный иммунитет и его характеристика
- Клетки иммунной системы
- Органы иммунной системы
- Молекулы MHC - система презентации пептидов при приобретенном иммунном ответе

