Механизмы развития (патофизиология) инфаркта миокарда
Инфаркт миокарда (ИМ) представляет собой гибель участка миокарда в результате длительной тяжелой ишемии. До настоящего времени это наиболее значимая форма ИБС. Около 1,5 млн человек в США ежегодно переносят ИМ.
а) Заболеваемость и факторы риска. ИМ может произойти практически в любом возрасте, однако частота его возникновения увеличивается с годами, особенно в случае генетической предрасположенности к атеросклерозу. Около 10% ИМ возникает у лиц моложе 40 лет и 45% — у лиц моложе 65 лет. Частота ИМ у лиц с белым и темным цветом кожи одинакова. На протяжении всей жизни риск ИМ у мужчин значительно выше, чем у женщин. Женщины защищены от ИМ и других болезней сердца в репродуктивном периоде, за исключением случаев, когда есть условия, предрасполагающие к атерогенезу.
Однако снижение уровня эстрогенов после менопаузы ассоциируется с быстрым увеличением заболеваемости ИБС, и ИБС становится наиболее распространенной причиной смерти женщин пожилого и старческого возраста. Тем не менее в настоящее время не считают, что заместительная гормональная терапия в постменопаузе защищает от атеросклероза и ИБС в достаточной степени.
б) Патогенез. Рассмотрим механизмы развития и последствия ишемии миокарда.
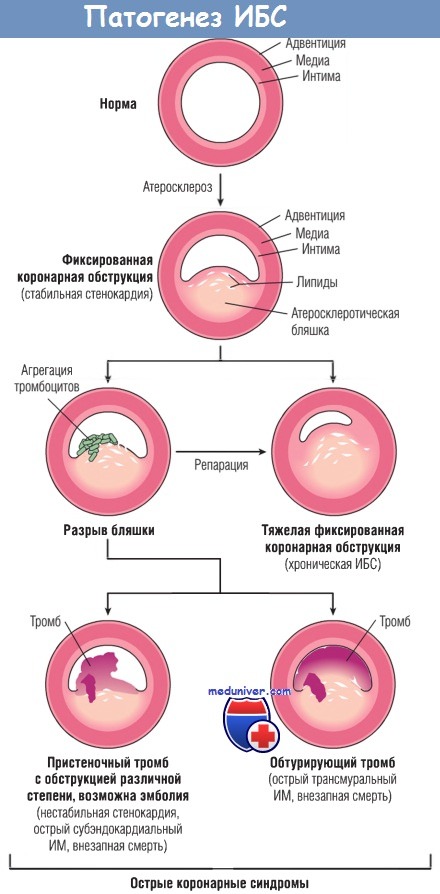
Окклюзия коронарных артерий. В типичных случаях ИМ наиболее вероятна следующая последовательность событий:
1. Первичным процессом является внезапное изменение атеросклеротической бляшки — геморрагия, эрозия, изъязвление, разрыв или растрескивание.
2. Когда обнажаются субэндотелиальный коллаген и некротическое содержимое бляшки, тромбоциты на этом участке адгезируют и активируются, высвобождая содержимое своих гранул, затем происходит агрегация с образованием микротромбов.
3. Медиаторы, высвобождаемые тромбоцитами, стимулируют спазм сосудов.
4. Тканевой фактор активирует процесс коагуляции, дополнительно увеличивая размер тромба.
5. Часто тромб, увеличиваясь в размерах, полностью закрывает просвет сосуда в течение нескольких минут.
Предложенная последовательность процессов основана на:
(1) данных аутопсии пациентов, умерших от острого ИМ;
(2) данных ангиографии, указывающих на высокую частоту тромботической окклюзии вскоре после ИМ;
(3) выраженном положительном эффекте коронарной реваскуляризации (например, с помощью тромболизиса, ангиопластики, применения стентов или хирургического вмешательства) после ИМ;
(4) обнаружении при ангиографии остаточных изменений атеросклеротических бляшек после тромболизиса.
Коронарная ангиография, выполненная в течение 4 час от начала ИМ, выявляет тромб в коронарной артерии в 90% случаев, а через 12-24 час от начала ИМ — только в 60% случаев, что свидетельствует о некоторой степени разрешения окклюзии благодаря фибринолизу и/или ослаблению спазма.
В 10% случаев трансмуральный ИМ происходит в отсутствие типичной патологии коронарных сосудов. В таких ситуациях ответственными за снижение коронарного кровотока могут быть другие механизмы:
- спазм сосудов. Может быть вызван различными причинами, например злоупотреблением кокаином, и может ассоциироваться с агрегацией тромбоцитов;
- эмболия. Эмболы попадают в коронарные артерии из левого предсердия при фибрилляции предсердий, пристеночном тромбозе в левых отделах сердца, вегетациях при инфекционном эндокардите, наличии внутри сердца протезного материала либо из правых отделов сердца или периферических вен {парадоксальные эмболы), проникая через открытое овальное окно;
- ишемия в отсутствие коронарного атеросклероза и тромбоза. Вероятно, к ишемии приводят такие нарушения во внутристеночных коронарных сосудах, как васкулит, гематологические заболевания (например, серповидно-клеточная анемия, амилоидоз) и расслоение стенки сосуда, а также снижение артериального давления (шок) или неправильная «защита» миокарда во время операции на сердце.
ИБС — ишемическая болезнь сердца; ИМ — инфаркт миокарда.
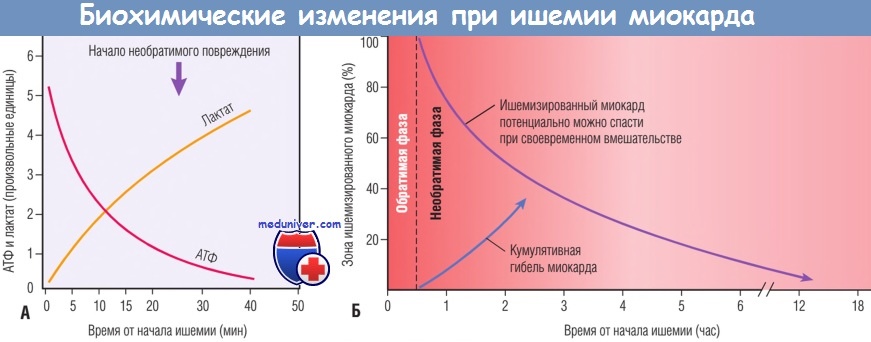
(А) Ранние изменения состоят в утрате аденозинтрифосфата (АТФ) и накоплении лактата.
(Б) В течение» 30 мин после начала даже тяжелой ишемии повреждение миокарда потенциально обратимо. Затем происходит прогрессирующая утрата жизнеспособности, которая завершается через 6-12 час.
Благоприятный эффект реперфузии максимален, если ее удается выполнить достаточно рано, и эффект снижается, если реперфузию выполняют позднее.
в) Реакция миокарда. Обструкция коронарной артерии снижает доставку крови в определенную область миокарда, вызывая ишемию, дисфункцию миокарда и возможную гибель кардиомиоцитов. Анатомическая область, снабжаемая кровью из этой артерии, является зоной риска. Исход зависит главным образом от тяжести поражения и продолжительности ограничения кровотока.
Ранним биохимическим последствием ишемии миокарда является прекращение аэробного метаболизма в течение нескольких секунд после начала ишемии, приводящее к недостаточному образованию высокоэнергетических фосфатов (креатинфосфата и аденозинтрифосфата) и накоплению потенциально вредных метаболитов (в частности, лактата). В результате исключительной зависимости функции миокарда от кислорода тяжелая ишемия индуцирует утрату сократимости уже в течение 1 мин. Прекращение функции способно вызвать острую сердечную недостаточность задолго до гибели клеток миокарда.
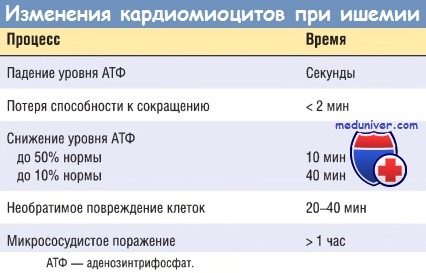
Ультраструктурные изменения (включая расслабление миофибрилл, истощение запасов гликогена, набухание клеток и митохондрий) также происходят в течение нескольких минут от начала ишемии. Тем не менее эти ранние изменения потенциально обратимы. Как показали экспериментальные и клинические исследования, лишь тяжелая ишемия длительностью 20-30 мин или более приводит к необратимому повреждению (некрозу) кардиомиоцитов. Ультраструктурные изменения при необратимом повреждении кардиомиоцитов (в первую очередь структурные дефекты сарколеммы) наблюдаются лишь после длительной, тяжелой ишемии миокарда (это происходит при снижении кровоснабжения до 10% нормы или ниже).
Ключевым признаком ранней фазы некроза кардиомиоцитов служит нарушение целостности сарколеммы, что позволяет внутриклеточным макромолекулам высвобождаться из клеток в интерстициальную ткань сердца и в конечном итоге — в микрососудистое русло и лимфатические сосуды области инфаркта. Тесты, позволяющие определить уровень белков миокарда в крови, имеют большое значение для диагностики и лечения ИМ (см. далее). При увеличении длительности тяжелой ишемии нарушается микроциркуляция. Прогрессирование этих процессов во времени представлено в таблице ниже.
В большинстве случаев острого ИМ необратимое повреждение сердца происходит после определенного периода времени, как правило через 2-4 час. Это дает возможность провести раннее вмешательство на коронарных сосудах для восстановления перфузии и спасти как можно больше миокарда, находящегося в зоне повышенного риска.
Прогрессирование ишемического некроза в миокарде в общем виде представлено на рисунке ниже. Ишемия наиболее выражена в зоне субэндокарда, т.е. необратимое поражение ишемизированных кардиомиоцитов происходит в первую очередь в субэндокардиальной зоне. При более обширной ишемии «фронт» гибели клеток распространяется, захватывая все большую площадь. На локализацию, размеры и морфологические признаки острого ИМ влияют следующие факторы:
- локализация, тяжесть и скорость развития коронарной обструкции вследствие атеросклероза и тромбоза;
- размер сосудистого ложа, перфузируемого сосудами, подвергшимися обструкции;
- продолжительность окклюзии;
- метаболические потребности миокарда и его потребность в кислороде в зоне повышенного риска;
- степень развития коллатеральных кровеносных сосудов;
- наличие, локализация и тяжесть коронарного спазма;
- другие факторы, например ЧСС, сердечный ритм и степень оксигенации крови.
Необратимое повреждение миокарда обычно завершается в течение 6 час от начала тяжелой ишемии миокарда. В тех случаях, когда система коллатеральных коронарных артерий развита в достаточной степени под влиянием хронической ишемии, этот срок удлиняется и может превысить 12 час.
Определение области миокарда, которую перфузируют основные коронарные артерии, помогает установить корреляцию между уровнем сосудистой обструкции и зоной ИМ. Передняя нисходящая ветвь левой коронарной артерии кровоснабжает большую часть верхушки сердца (дистальный отдел желудочков), переднюю стенку левого желудочка и передние две трети межжелудочковой перегородки. Коронарную артерию (правую коронарную или огибающую), перфузирующую заднюю треть межжелудочковой перегородки, называют доминантной (несмотря на то что передняя нисходящая и огибающая артерии вместе перфузируют большую часть миокарда левого желудочка).
При доминантной правой коронарной артерии, что встречается у 80% индивидов, огибающая артерия перфузирует только латеральную стенку левого желудочка, а правая коронарная артерия снабжает всю свободную стенку правого желудочка, заднебазальную стенку левого желудочка и заднюю треть межжелудочковой перегородки. Таким образом, повреждение левого желудочка может вызвать окклюзия как правой, так и левой коронарной артерии. Правая и левая коронарные артерии функционируют как концевые артерии, хотя анатомически в большей части сердца присутствуют многочисленные межкоронарные анастомозы (сосудистые соединения, обеспечивающие коллатеральное кровообращение).
В здоровом сердце через коллатерали проходит небольшое количество крови, однако, когда артерия резко сужена, кровь из системы с высоким давлением в систему с низким давлением проходит через коллатерали и вызывает их расширение. Таким образом, расширение и развитие коллатералей под влиянием ишемии могут играть важную роль в кровоснабжении областей миокарда, которые без этого могут быть лишены необходимой перфузии.
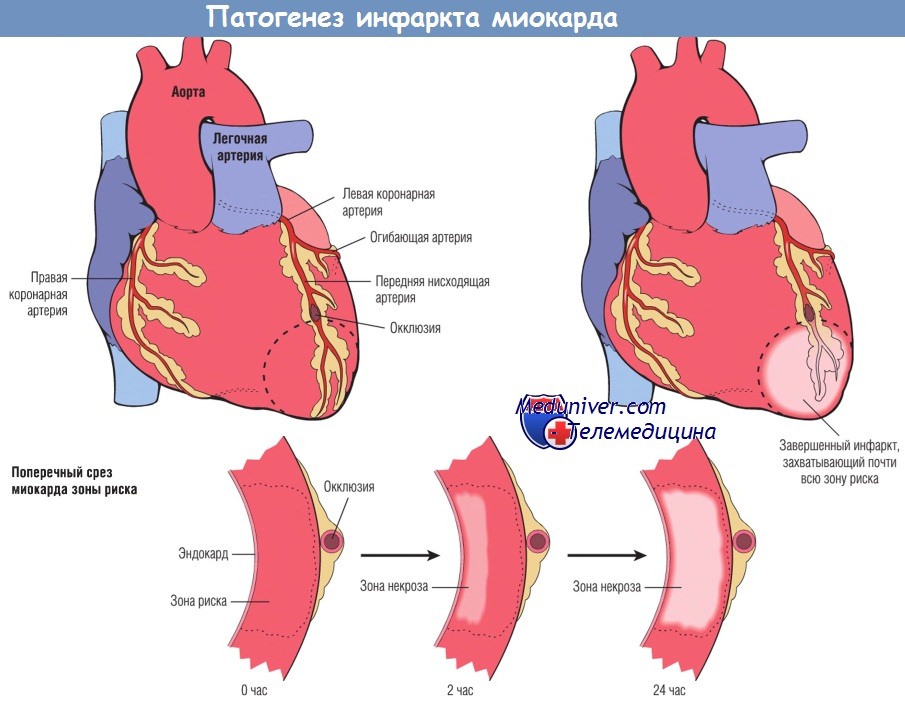
Некроз начинается в небольшой области миокарда под эндокардом, в центре ишемизированной зоны.
Область, перфузируемая обтурированной артерией, является зоной риска поражения миокарда (область внутри пунктирной линии).
Обратите внимание, что очень узкая область миокарда, находящаяся непосредственно под эндокардом, не подвергается некрозу, т.к. в нее поступает кислород из крови путем диффузии непосредственно из полости желудочка.

Видео этиология, патогенез инфаркта миокарда
- Рекомендуем ознакомиться со следующей статьей "Различия трансмурального и субэндокардиального инфаркта миокарда"
Оглавление темы "Патогенез ишемической болезни сердца":- Механизмы развития (патофизиология) ишемической болезни сердца
- Механизмы развития (патофизиология) стенокардии
- Механизмы развития (патофизиология) инфаркта миокарда
- Различия трансмурального и субэндокардиального инфаркта миокарда
- Морфология инфаркта миокарда
- Механизмы развития (патофизиология) реперфузии инфаркта миокарда
- Клиника и маркеры инфаркта миокарда
- Механизмы развития (патогенез) осложнений инфаркта миокарда
- Механизмы развития (патогенез) хронической ИБС
- Механизмы развития (патогенез) внезапной сердечной смерти

