Репарация ДНК и наследственные болезни. Пигментная ксеродерма.
В 1964 г. была показана решающая роль эксцизионной репарации в восстановлении поврежденной ультрафиолетом ДНК Е. соli. Было высказано предположение, что соответствующие механизмы у эукариот имеют более сложную организацию, поскольку призваны обеспечить более высокий уровень надежности. Уникальное значение систем репарации ДНК для нормального функционирования организма человека становится совершенно очевидным при анализе заболеваний обусловленных нарушением работы репарационных механизмов.
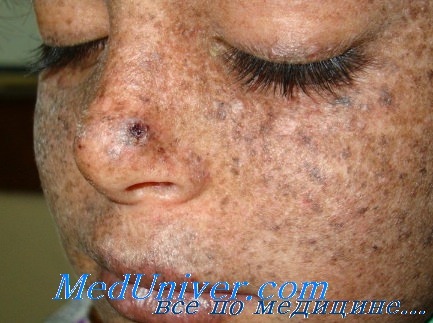
Классический пример такого рода болезней - пигментная ксеродерма (ХР от англ. Xeroderma pigmentosum) - редкая, наследуемая по аутосомно-рецессивному типу патология. В результате повышенной чувствительности к солнечному свету (ультрафиолету) у больных уже в раннем возрасте появляются пигментация, сухость кожи, изъязвления, рубцы, а затем развивается рак кожи, включая меланомы и карциномы. Средний возраст появления первой опухоли у ХР-пациентов - 8 лет, а вероятность развития карцином слизистой рта в 20 000 раз превышает средние значения в популяции. Частота встречаемости заболевания в разных странах составляет от 1/250 000 человек до 1/40 000 человек.
Показано, что у культивируемых фибробластов ХР-больных сокращается время жизни после УФ-облучения. Кроме того, выживаемость различных УФ-облученных вирусов, выращиваемых в культуре ХР-клеток, меньше, чем при их культивировании в нормальных клетках, что косвенно свидетельствует о дефектах систем восстановления от повреждений ДНК в ХР-клетках. Существенная особенность пигментной ксеродермы - наличие примерно у трети пациентов неврологических симптомов, обусловленных ранней гибелью нейронов, те. эксцизионная репарация играет важную роль в обеспечении продолжительности их жизни. Было обнаружено, что в клетках ХР-больных вырезание димеров у большинства пораженных, по-видимому, связано с нарушениями эксцизии ил и более ранней стадии - распознавания поврежденного участка. Выраженная гетерогенность ХР (клинических различий между разными пациентами сданным заболеванием) может быть обусловлена возникновением дефектов либо в различных сайгах одного и того же гена, либо в генах, кодирующих разные полипептиды. Для решения этой проблемы использовали метод непарной клеточной гибридизации фибробластов от разных ХР-больных.
Анализ результатов был основан на том, что дочерняя гибридная клетка, может осуществлять эксцизионную репарацию, если дефекты ферментов репарации связаны с разными локусами. В таком случае наличие одного неповрежденного фермента обеспечивается одним геномом, а другого - вторым геномом, взаимно компенсируя дефекты. Если же ферментативные дефекты идентичны, то даже при повреждении разных сайтов одного гена, компенсация невозможна и гибридная дочерняя клетка будет иметь репарационный дефект. С помощью этого метода было идентифицировано 7 групп комплементации (7 различных локусов) в случае дефектов генов эксцизи-онной репарации ХР (А, В, С, D, E, F, G),h 1 группа-связанная с дефектом постре-пликативной репарации (около 20% среди всех больных пигментной ксеродермой), так называемая ХР. Между группами комплементации, и даже внутри одной комплементационной группы наблюдаются выраженные клинические различия. Большинство генов, мутации которых вызывают пигментную ксеродерму, известны, и соответствующие белки по своим функциям в целом сходны с ферментами прокариотической эксцизионной репарации.
Но частоты встречаемости разных групп комплементации в разных странах различны: в Европе наиболее распространена группа ХРС, в Японии - ХРА. Причем среди европейских пациентов не было обнаружено групп ХРВ и XPF, а в Японии при таком же отсутствии группы ХРВ группа XPF была представлена значительным количеством индивидов.
Продукт гена ХРА, картированного в длинном плече девятой хромосомы (9q34.1), — это ДНК-связывающий белок, имеющий два цинковых «пальца». В облученных ультрафиолетом клетках ДНК-связывающие свойства этого белка усиливаются в 1000 раз. Показано, что для осуществления эксцизионной репарации необходимы С-конец и один из цинковых «пальцев». Белковым продуктом гена ХРВ, картированного в локусе q21 хромосомы 2 —(2q21), является геликаза, входящая в состав TFIIH-фактора транскрипции размером 89 кДа. Ген ХРС, предварительно картированный на хромосоме 3, кодирует белок Р125, функция которого пока не совсем ясна. Тем не менее, показано его участие совместно с полипептидом Р58 в восстановлении репарационной активности. Ген XPD, подобно гену ХРВ, кодирует одну из субъединиц фактора транскрипции TFIIH размером около 87 кДа (общее число этих субъединиц не менее 5 и, вероятно, более 9). Ген XPD картирован в локусе (q 13.2-q 13.3) хромосомы 19; его белковый продукт имеет геликазную активность. Ген XPF, картированный в коротком плече хромосомы 16 - (16р 13.13), по-видимому, продуцирует эндонуклеазу, надрезающую ДНК с 5'-стороны.
А продуктом гена XPG, локализованного в длинном плече хромосомы 13 — (13q33), является эндонуклеаза, надрезающая ДНК с противоположной — 3'-стороны. Рисунок отражает взаимодействие вышеописанных белковых продуктов в процессе эксцизионной репарации. Важно отметить, что повышенный риск новообразований уже в молодом возрасте, по ряду данных, связан с увеличением интенсивности УФ-излучения, вызывающим перегрузку эксцизионной системы репарации, которая успешно справляется с низким уровнем облучения. Так установлено, что для гетерозигот по пигментной ксеродерме вероятность возникновения рака кожи повышена на юге США, но не в других районах этой страны.
Установлено, что в клетках пациентов с ХР пиримидиновые димеры удаляются с такой же скоростью и эффективностью, что и в клетках здоровых доноров, т.е. при внешних признаках болезни дефекты эксцизионной репарации не обнаруживаются. У таких больных выявляется другое нарушение - полная репликация поврежденных участков ДНК. Подобный дефект пострепликативной репарации наблюдается и в других группах больных ХР, но в значительно меньшей степени. Таким образом, в случае XP превалирующим фактором является изменение параметров репликации ДНК.
- Читать далее "Синдром Коккейна. Трихотиодистрофия. Генетические основы синдрома Коккейна и трихотиодистрофии."
Оглавление темы "Репликация ДНК - виды и механизмы.":1. Элонгация цепей ДНК. Элонгация как этап синтеза ДНК.
2. Репликация ДНК. Характеристика параметров репликации.
3. Двунаправленность репликации ДНК. Полирепликонность и асинхронность репликации.
4. Восстановление или репарация ДНК. Нарушение первичной структуры ДНК.
5. Виды репарации ДНК. Фотореактивация.
6. Репарация ДНК за счет ДНК-полимераз. Эксцизионная репарация ДНК.
7. Исправление ошибок спаривания ДНК. Мисмэтч-репарация. Рекомбинационная репарация.
8. SOS репарация ДНК. Характеристика и механизмы SOS репарации ДНК.
9. Репарация ДНК и наследственные болезни. Пигментная ксеродерма.
10. Синдром Коккейна. Трихотиодистрофия. Генетические основы синдрома Коккейна и трихотиодистрофии.

