Обмен гистидина и активность гистидинидазы в организме
Гистидинемия относится к наследственным нарушениям обмена гистидина и обусловлена отсутствием или же недостаточной активностью гистидазы. Заболевание впервые описано Ghadimi и соавт. в 1961 году. В результате метаболического блока происходит накопление в крови гистидина и его производных (имида-золпировипоградной, имидазолуксусной и имидазолмолочной кислот) и снижение концентрации уроканиновой, глютаминовой и других кислот. Тип наследования — аутосомно-рецессивный.
Термин «гистидинемия» предложен Auerbach с соавт. в 1962 году. С тех пор в мировой литературе описано свыше 80 и выявлено в различных странах по программам массового скрининга среди новорожденных около 90 больных гистидинемией.
По своей химической природе гистидин — это а-аминоимидазолпропионовая кислота. По данным Stifel и Herman, биосинтез гистидина был изучен только у растений и микроорганизмов. В точение последних лет в литературе широко обсуждается вопрос о том, заменимой или незаменимой аминокислотой является гистидин. До сих пор имеются противоречивые точки зрения. Так, для многих животных гистидин — незаменимая аминокислота. Что же касается человека, то до настоящего времени единой точки зрения не существует.
Snydorman и соавт. показали, что для детей первого года жизни гистидин — незаменимая аминокислота, так как на диете с ограничением гистидина в этом возрасте отмечалось нарушение ретенции азота, плохая прибавка массы тела, появление шелушения кожи и экзематозных высыпаний и др. Однако возраст, когда организм начинает синтезировать гистидин, определен не был. Kopplo и Swendsoid получили доказательства незаменимости гистидина и для здоровых взрослых, у которых при длительном приеме свободной от гистидина пищи отмечались отрицательный азотистый баланс, значительное снижение уровня гистидина в плазме и мышцах, снижение сывороточного альбумина, признаки угнетения эритропоэза (снижение содержания гемоглобина и количества ретикулоцитов в крови, повышение сывороточного железа) и клинические симптомы (недомогание, анорексия, сухость и шелушение кожи, эритематозные высыпания).
Указанные симптомы исчезли после добавления в пищу гистидина. Признаки анемии с нарушением эритропоэза объясняются авторами уменьшением образования гемоглобина, в состав которого входит большое количество гистидина. Таким образом, в настоящее время, по-видимому, можно рассматривать гистидин как незаменимую аминокислоту не только для детей, но и для взрослых. Однако для окончательного решения этого вопроса необходимы дальнейшие исследования.
Минимальная суточная потребность в гистидине, определенная Snyderman и соавт. у детей первого года жизни, составляет 16—34 мг на 1 кг массы тела.
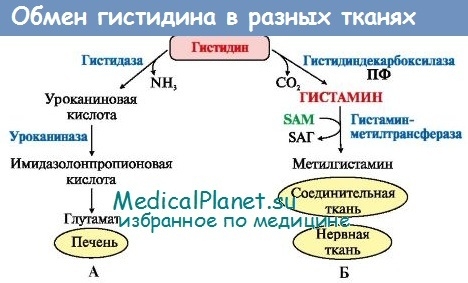
Метаболизм гистидина в тканях млекопитающих изучен довольно подробно. Источниками его служит пища и распад собственных белков организма. Известны следующие основные пути обмена этой аминокислоты:
1) участие в синтезе белка,
2) метилирование с образованием 1- и 3-метилгистидина,
3) конденсирование с b-аланином в карнозин с последующим метилированием и образованием ансерина,
4) декарбоксилированис в гистамин с последующим окислением в имидазолуксусную кислоту,
5) трансамипирование в имидазолпировиноградную кислоту и затем в имидазолмолочную и имидазолуксусную кислоты.
Дезаминированием гистидина с образованием уроканиновой кислоты начинается главный путь его катаболизма. В нем участвуют четыре энзима (Stifel, Herman): гистидаза, или а-дезаминаза гистидина, уроканиназа, имидазолонпропионатгидролаза и формиминотрансфераза. При этом образуются следующие метаболиты: уроканиновая, имидазолонпропионовая, формиминоглутаминовая, глутаминовая и метил- или формилтетрагидрофолиевая кислоты, которые участвуют в синтезе пуриновых и пиримидиновых оснований. Указанный путь является наиболее важным и эффективным по сравнению с другими путями обмена, этим путем катаболизируется большая часть гистидина.
Известно, например, что на образование такого физиологически активного метаболита, как гистамин, у животных тратится только около 1% гистидина (Ghadimi, Zischka).
В норме многие производные гистидина в очень небольших количествах присутствуют в моче. Это — уроканиновая, имида-золпировиноградная, имидазолуксусная, имидазолмолочная и имидазолпропионовая кислоты, карнозин, ансерии, гомокарнозин, b-аспартилгистидин. Формиминоглутаминовая кислота в моче в достаточных количествах определяется только в условиях дефицита витамина B12 или фолиевой кислоты. Уроканиновая кислота, кроме мочи, обнаруживается также в поте здоровых людей (La Du и соавт., Auerbach и соавт.) и роговом слое кожи (Baden и соавт.). Однако присутствие ее в поте является не следствием функции потовых желез, а результатом механического вымывания при сборе пота на фильтровальную бумагу, соприкасающуюся с поверхностью кожи.
Есть предположение, что уроканиновая кислота защищает кожу от эритемогенного действия ультрафиолетовых лучей и ингибирует образование гистамина, на чем основано ее применение при зудящих дерматозах (С. Р. Мардашев и соавт.).
При изучении распределения ферментов уроканинового пути обмена гистидина в организме млекопитающих наиболее высокая активность гистидазы и уроканиназы обнаружена в печени. Кроме того, довольно высокая активность гистидазы отмечена в роговом слое кожи. Небольшая активность гистидазы определяется в сердечной мышце, почках, селезенке, а в лейкоцитах она отсутствует (Zannoni, La Du). В сыворотке крови гистндаза обнаруживается только при различных поражениях печени и служит показателем выраженности белковой дистрофии паренхиматозных клеток (С. Р. Мардашев, В. А. Буробин, Н. А. Леонова). Отсутствие гистидазы в сыворотке крови здоровых людей объясняют прочной связью фермента со структурными образованиями клетки, в основном с митохондриями.
По данным различных авторов, активность гистидазы очень лабильна. Она снижается при применении медикаментов, варьирует в зависимости от места взятия кожи (в коже рук активность в 1,5—4 раза выше, чем в коже ног); возможно, это связано с тем, что мягкая кожа обладает более высокой активностью, чем твердая, мозолистая (Kihara и соавт.). Активность гистидазы увеличивается при ультрафиолетовом облучении, дефиците тиамина, повышении содержания белка в диете, эстрогенной стимуляции. В опытах на крысах активность фермента снижалась в результате овариоэктомии и восстанавливалась после назначения эстрадиола (Stifel, Herman). В. А. Буробин и соавт. активацию гистидазы гормонами (глюкагон, эстрогены) и медикаментами (теофиллин, кофеин) объясняют влиянием на ферментные системы: активированием аденилциклазы, катализирующей превращение АТФ в циклический 3',5'-АМФ, или ингибированием фосфодиэстеразы, расщепляющей циклический 3',5'-АМФ.
Отмечена способность экзогенного L-глутамина индуцировать синтез гистидазы или активировать фермент в коже людей. Обнаружено, что восстановленный глутатион повышает активность гистидазы в печени in vitro. Низкое содержание гистидазы в коже встречается при некоторых патологических состояниях, помимо гистидинемии: псориазе, экземе, нейродермите, злокачественных новообразованиях кожи и внутренних органов — желудка, легких, а также при некоторых формах глухоты (С. Р. Мардашев и соавт.).
Таким образом, активность гистидазы подвержена различным влияниям и зависит как от состояния самого организма, так и экзогенных воздействий.
- Рекомендуем далее ознакомиться со статьей "История открытия гистидиемии и ее причины"
Оглавление темы "Болезни обмена аминокислот":- Обмен гистидина и активность гистидинидазы в организме
- История открытия гистидиемии и ее причины
- Клиника гистидиемии и ее проявления у детей
- Диагностика гистидинемии и анализы при ней
- Пример гистидинемии у ребенка
- Методы диагностики гистидинемии - анализы
- Причины гомоцистинурии и ее варианты
- Аномалии скелета и соединительной ткани при гомоцистинурии
- Церебральные расстройства при гомоцистинурии
- Поражение зрения и сердечно-сосудистой системы при гомоцистинурии

