Обмен жиров в норме (метаболизм жиров)
а) Обмен холестерина. Холестерин — это органическое липофильное соединение с молекулярной массой 387 Да, и, безусловно, самый распространенный из всех стероидных спиртов плазмы. Холестерин синтезируется в клетках организма, и этот источник дает около 75% всего холестерина в кровотоке.
Холестерин является предшественником желчных кислот — холевой и хенодезоксихолевой, и стероидных гормонов, включая эстроген, тестостерон и кортизол. Холестерин также является важным компонентом клеточных мембран. Предшественниками холестерина являются латостерин и десмостерол, которые можно измерить в плазме или сыворотке, и их высокие показатели указывают на повышенный синтез холестерина. Пациенты с повышенным синтезом холестерина имеют повышенные абсолютные значения этих компонентов, а также повышенные нормализованные отношения к уровню холестерина крови.
Синтез холестерина повышен у пациентов с ожирением и метаболическим синдромом. Встречаются также пациенты с нарушением синтеза желчной хенодезоксихолевой кислоты из холестерина, что приводит к церебротендинозному ксантоматозу.
Существует множество патогенетических путей нарушения синтеза холестерина из ацетата. Ферментом, регулирующим уровень синтеза холестерина, является 3-гидрокси-3-метилглютарил КоА редуктаза или HMG СоА редуктаза. Статины конкурентно ингибируют этот фермент, благодаря чему снижается синтез холестерина в организме и на клеточном уровне более чем на 80%. Клетки отвечают на это повышением уровня и активности рецепторов к ЛНП на своей поверхности, увеличивая тем самым поступление ЛНП из крови в клетку и снижая уровень холестерина ЛНП в плазме. Тем не менее, в клетках кишечника статины также могут увеличить абсорбцию холестерина. Статины особенно эффективны у пациентов с повышенными уровнями маркеров синтеза холестерина, и менее эффективны у пациентов с повышенными плазменными маркерами абсорбции.
Холестерин также всасывается в кишечнике. Около 25% холестерина крови является алиментарным, т.е. поступает из продуктов питания. Холестерин, обнаруженный в кишечнике, является пищевым, а также синтезируется печенью, секретируется в желчь и реабсорбируется. Основными источниками холестерина являются яйца, масло, цельное молоко и животные жиры, в том числе из мяса. Похожие на холестерин вещества в растительных клетках также известны под названием фитостеролов (β-ситостерол и кампестерол). Почти весь холестерин из пищи и фитостеролы транспортируются в кишечник посредством белка-транспортера Ниманна-ПикаС (NPC1L1). Этот процесс на 50% блокируется эзетимибом — специфическим ингибитором NPC1L1.
Холестерин в клетках кишечника либо входит в состав хиломикронов и липопротеинов высокой плотности (ЛВП) и проникает таким образом в кровоток, либо остается в виде свободного холестерина или холестериновых эфиров (холестерин с присоединенной жирной кислотой), или транспортируется назад в просвет кишечника благодаря действию двух транспортеров — АТФ-связывающих кассетных транспортеров G5 и G8 (ABCG5 и ABCG8). Около 50% алиментарного холестерина и более 95% алиментарного β-ситостерола и кампестерола транспортируются обратно в полость кишечника с помощью АВС-транспортеров. Пациенты, имеющие дефекты ABCG5 и ABCG8, имеют повышенный уровень (Кситостерола плазмы, что называется фитостеролемией, и у них часто развиваются сухожильные ксантомы.
б) Обмен липопротеинов плазмы. Холестерин, триглицериды и фосфолипиды находятся в плазме или сыворотке в составе липопротеинов. Эти частицы имеют поверхностный слой фосфолипидов (каждый фосфолипид содержит две соединенные молекулы жирных кислот) и жирных кислот, ориентированных центростремительно в область ядра частицы, а также белки под названием аполипопротеины, и свободный холестерин. Гидрофобные компоненты липопротеинов, а именно холестериновый эфир и триглицериды, содержатся в составе ядра шарообразных липопротеиновых частиц. Плазматические липопротеины различаются по размерам и плотности, варьируя от очень крупных липопротеинов, богатых триглицеридами, с плотностью < 0,94 г/мл, образующихся в кишечнике (хиломикроны), до мелких ЛВП с плотностью до 1,21 г/мл.
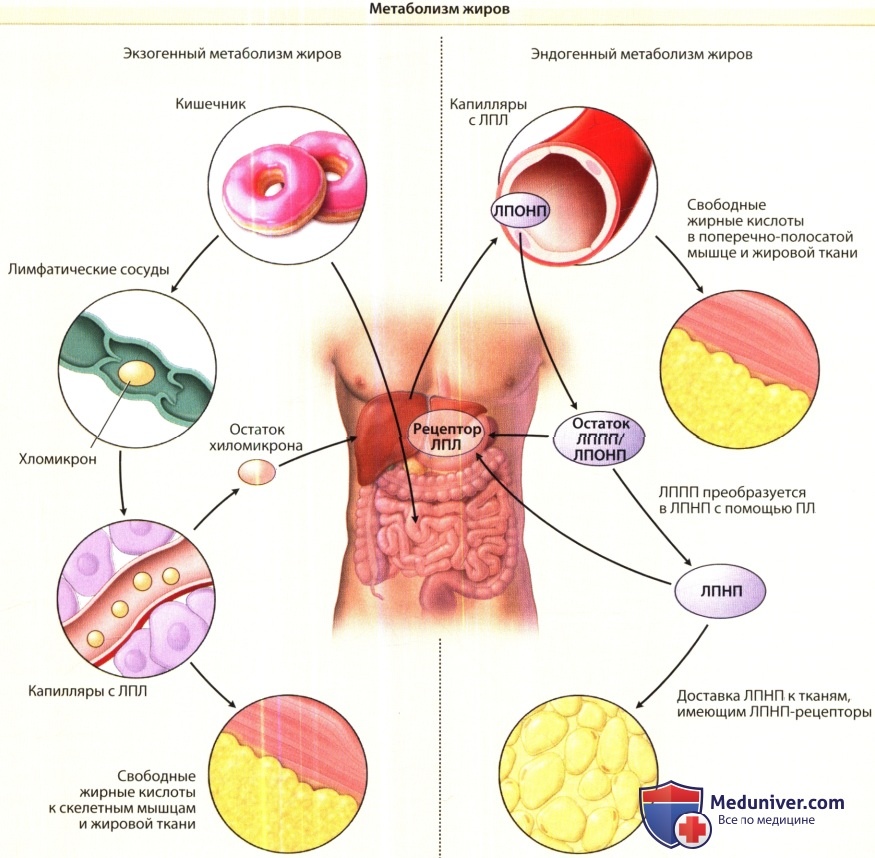
Экзогенный путь метаболизма липидов включает прием пищи, содержащей жир, и доставку жирных кислот к тканям.
Триглицериды в кишечнике входят в состав хиломикронов в энтероцитах тонкой кишки.
Капиллярная липопротеинлипаза (ЛПЛ), которая в качестве кофактора требует аполипопротеина С (апо-С), гидролизует триглицериды и высвобождает жирные кислоты в периферические ткани.
Оставшиеся молекулы хиломикронов, называемые остатками хиломикронов, перерабатываются в печени. Эндогенный путь метаболизма липидов включает печеночную продукцию липопротеинов очень низкой плотности (ЛПОНП) и доставку свободных жирных кислот в периферические ткани. Молекулы ЛПОНП вместо апо-В48 имеют апо-В100.
ЛПЛ, которая требует в качестве кофактора апо-С, гидролизует триглицериды и высвобождает жирные кислоты в периферические ткани. Такой остаток называется липопротеином промежуточной плотности (ЛППП). Рецептор ЛПНП, находящийся в печени, удаляет эти остатки путем связывания с ними апо-Е. ЛППП также могут превращаться в ЛПНП при помощи печеночной липазы (ПЛ) в печени. Новые молекулы ЛПНП могут связываться с рецептором ЛПНП при помощи апо-В100.
в) Обмен хиломикронов. Липопротеины под названием «хиломикроны» синтезируются в кишечнике и значительно варьируют по массе (50—1,000х106 Да) и размерам (диаметр 75-1,200 нм), имеют плотность <0,93 г/мл, и при электрофорезе липопротеинов они мигрируют первыми. Эти частицы очень богаты триглицеридами (около 85% веса частицы) и содержат около 3% холестеринового эфира. Эти частицы также могут переносить в своем составе значительное количество жирорастворимых витаминов, в том числе витамин А в виде ретинилпальмитата, каротиноиды, витамин Д, витамин Е в виде α- или γ-токоферола, и витамин К. На своей поверхности хиломикроны содержат около 2% белков, 2% свободного холестерина и 7% фосфолипидов. Главный белок этих частиц известен под названием аполипопротеин (апо)В-48. После того, как хиломикроны попадают в лимфу, их обширная поверхность обогащается апо-A-I, апоA-IV и С-аполипопротеинами (С-1, С-П и C-III). Среднее значение суточного синтеза апо-В-48 у человека составляет около 2 мг/кг/день.
Как только хиломикроны попадают в кровоток, значительная часть триглицеридов быстро перемещается под действием липопротеинлипазы (ЛПЛ). ЛПЛ отщепляет свободные жирные кислоты от глицериновой основы триглицеридов. В этой реакции апоС-II действует как кофактор для ЛПЛ, a апоAV ускоряет вызванный ЛПЛ липолиз триглицеридов. Свободные жирные кислоты поглощаются соседними миоцитами и адипоцитами. Некоторые жирные кислоты связываются альбумином и поглощаются жировой тканью или переносятся в другие различные ткани организма, включая печень. В жировой ткани свободные жирные кислоты снова превращаются в триглицериды для долгосрочного хранения энергии. АпоС-Ш ингибирует этот процесс с помощью липолиза. Когда большая часть триглицеридов из хиломикронов израсходована, частицы в обмен на триглицериды поглощают эфиры холестерина из ЛПВП с помощью белка-переносчика холестеринового эфира (СЕТР). Таким образом, хиломикроны становятся значительно меньше по размеру и называются остаточными хиломикронами.
В процессе образования ремнантного хиломикрона частицы передают практически все поверхностные апоА-1, апоA-IV, апоA-V и С-аполипопротеины в ЛПВП, но сохраняют весь апоВ-48 и получают из ЛПВП апо-Е. Время пребывания хиломикронов, насыщенных триглицеридами, в плазме составляет около 5-10 минут, тогда как хиломикронов апоВ-48 — около 5 часов. Остаточные хиломикроны поглощаются клетками печени, что регулируется связыванием апоЕ с рецепторами для ЛНП.
г) Обмен липопротеинов очень низкой плотности (ЛОНП). Липопротеины очень низкой плотности (ЛОНП) синтезируются в печени. Они имеют разную молекулярную массу (10-80x106 Да) и размер (диаметр 30-80 нм), имеют плотность плазмы 0,93-1,006 г/мл, и при электрофорезе находятся между ЛВП и ЛНП (пре-β область) Эти частицы богаты триглицеридами (около 60% массы в центре частицы) и содержат около 10% холестеринового эфира. На их поверхности имеется около 8% белка, 7% свободного холестерина и 15% фосфолипидов. Хотя они похожи на хиломикроны, основным белком этих частиц является апоВ-100, тогда как у хиломикронов апоВ-48. Другие поверхностные белки включают апоС-I, апоСII и апоС-Ш. Среднее ежедневное количество образующихся ЛОНП апоВ-100 у человека составляет 20 мг/кг/день. Когда ЛОНП попадает в кровоток, частицы насыщаются апоЕ и другими липопротеинами из ЛВП. Большинство триглицеридов ЛОНП быстро перемещается под действием липопротеинлипазы, как и в хиломикронах кишечника.
В жировой ткани свободные жирные кислоты вновь превращаются в триглицериды для длительного хранения энергии. Как и в хиломикронах, апоС-Ш ингибирует этот процесс липолиза. Как только ЛОНП диссоциируют с ЛПЛ, они превращаются в липопротеины промежуточной плотности (ЛНП) которые содержат приблизительно одинаковое количество холестерина и триглицеридов. Печень поглощает ЛПП путем присоединения апоЕ к рецептору для ЛНП и последующего эндоцитоза ЛПП. Они превращаются в ЛНП благодаря печеночной липазе (ПЛ). Этот процесс занимает 4-5 часов.
д) Обмен липопртеинов низкой плотности (ЛНП). Липопротеины низкой плотности (ЛНП) являются конечным продуктом катаболизма ЛОНП и образуются, главным образом, в процессе превращения ЛОНП в ЛПП и затем в ЛНП. Они являются главными липопротеинами, транспортирующими холестерин в плазме. ЛНП имеют молекулярную массу около 2х106 Да, диаметр 18-25 нм, плотность плазмы 1,019-1,063 г/мл, и при электрофорезе перемещаются в бета-область. Эти частицы обогащены холестериновым эфиром (около 40% в центре частицы) и содержат около 5% триглицеридов. На поверхности частиц имеется около 25% протеинов, 10% свободного холестерина и 20% фосфолипидов. Основным белком ЛНП является апоВ-100. Иногда ЛНП может содержать незначительное количество поверхностных протеинов, называемых апоС-I, апоС-II, апоС-III и апоЕ. Среднее ежедневное превращение ЛОНП апоВ-100 в ЛНП апоВ-100 у человека занимает около 4-5 часов, и составляет около 12 мг/кг/день.
В плазме здорового человека ЛНП содержат около 60%-70% общего холестерина и около 80-90% общего апоВ. ЛНП апоВ-100 в плазме сохраняется в течение 3,5 дней и поглощается различными тканями благодаря ЛНП-рецептору. ЛНП разделяются на более крупные ЛНП (плотность 1,019-1,044 г/мл) и мелкие плотные ЛНП (плотность 1,044-1,063 г/мл). Последние считаются более атерогенными, чем крупные ЛНП, и апоВ-100 на их поверхности имеет значительно большее время жизни в плазме, чем апоВ-100 на поверхности крупных ЛНП.
Другой липопротеин, похожий на ЛНП,—это липопротеин (а), или ЛП(а). Эта частица часто имеет вид мелкого плотного ЛНП с поверхностным белком апо(а), соединенным с апоВ-100. Белок апо(а) имеет множество различных копий доменов «двойная петля»-4 и одну копию домена «двойная петля»-5. Эти структуры в высшей степени гомологичны доменам «двойная петля» плазминогена, необходимого для лизиса тромбов. Высокий уровень ЛП(а) (> 30 мг/дл) связан с повышенным риском ишемической болезни сердца. ЛП(а) является атерогенным, поскольку он не только оседает на артериальных стенках, но также может предотвратить лизис тромба плазминогеном. Более того, ЛП(а) служит акцептором окисленных фосфолипидов из ЛНП.
е) Обмен липопротеинов высокой плотности (ЛВП). Липопротеины высокой плотности (ЛВП) (плотность 1,063-1,21 г/мл) содержат около 50% белка, 30% фосфолипидов, 20% триглицеридов и 5% триглицеридов. При электрофорезе ЛВП находятся в альфа-диапазоне и имеют диаметр около 5,5-12 нм. Основными белками ЛВП являются апоА-I, апоА-II. Время жизни ЛВП апоА-I составляет около 4,5. ЛВП участвует в обратном транспорте холестерина, при котором ЛВП поглощает холестерин из клеток периферических тканей и затем доставляет его в печень для экскреции или насыщения им липопротеинов в обмен на триглицериды. В ЛВП фермент лецитин-холестерин-ацилтрансфераза (ЛХАТ) является катализатором для образования эфира холестерина, который затем попадает в липопротеины с помощью транспортного белка холестериновых эфиров.
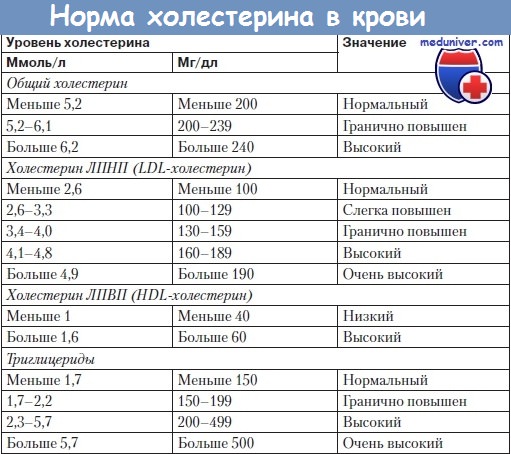
Низкий холестерин ЛВП < 40 мг/дл является значимым фактором риска ишемической болезни сердца.
Ксантомы образуются в результате избыточного отложения липидов в коже или сухожилиях, миграции туда моноцитов и поглощения липидов фагоцитарным рецептором на поверхности макрофагов (образуются из моноцитов). Клинически у пациентов с повышенным количеством хиломикронов и ЛОНП, остаточных липопротеинов, ЛНП, ЛП(а) происходит избыточный синтез холестанола, избыточная абсорбция растительных стеролов, отмечается значительное снижение ЛВП либо имеется моноклональная гаммопатия, также развитие ксантом может быть вызвано множественной миеломой.
У пациентов с дефектом катаболизма триглицеридов в хиломикронах и ЛОНП развивается тяжелая гипертриглицеридемия, которая приводит к появлению эруптивных ксантом. У пациентов с патологией поглощения остаточных хиломикронов и ЛОНП развивается сочетанная гиперлипидемия и тубоэруптивные ксантомы. Такие ксантомы также можно наблюдать при значительном дефиците Л ВП в связи с недостаточностью синтеза ЛВП апоА-I. У пациентов с патологией поглощения ЛНП наблюдается очень высокий уровень ЛНП холестерина и появляются сухожильные ксантомы. Такие ксантомы также можно наблюдать у пациентов с избыточным синтезом холестанола или чрезмерной абсорбцией фитостеролов. В результате этого и холестанол, и фитостеролы (β-ситостерол и кампестерол) в избытке переносятся частицами ЛНП.
Для семейных нарушений липидного обмена, связанных с ранним развитием ишемической болезни сердца, развитие ксантом нехарактерно.
К распространенным генетическим нарушениям обмена липопротеинов, связанным с преждевременным развитием ишемической болезни сердца, относятся семейный избыток ЛП(а) (ЛП(а) > 30 мг/дл), который наблюдается примерно у 20% семей с ранней ИБС, семейная комбинированная гиперлипидемия (холестерин ЛНП > 160 мг/дл и триглицериды >150 мг/дл) (15% семей) и семейная дислипидемия (триглицериды > 150 мг/дл, холестерин ЛНП <40 мг/дл) (5% семей). У пациентов со значительно повышенным уровнем ЛП(а) или холестерина ЛНП и триглицеридов на фоне семейной комбинированной гиперлипидемии иногда наблюдаются сухожильные или туберозно-эруптивные ксантомы. К тому же, у пациентов с повышенным уровнем триглицеридов (>400 мг/дл) и низким холестерином ЛВП (<40 мг/дл), либо изолированной выраженной недостаточностью ЛВП могут иногда развиваться туберозно-эруптивные ксантомы. Болезнь Танжера является редким аутосомно-рецессивным заболеванием, часто приводящим к ИБС, но, как правило, не вызывающим развитие ксантом.
Учебное видео расшифровки биохимического анализа крови
- Рекомендуем далее ознакомиться со статьей "Болезни с сухожильными ксантомами: семейная гиперхолестеринемия, дисбеталипопротеинемия"
Редактор: Искандер Милевски. Дата публикации: 7.12.2018

