Кожный некротизирующий васкулит: частота встречаемости, причины, механизмы развития
Кожный некротизирующий васкулит - краткий обзор:
• Патогномоничная сыпь — эритематозные папулы, не бледнеющие при надавливании, известные как пальпируемая пурпура.
• Пальпируемая пурпура сохраняется в течение 1-4 недель и разрешается иногда с тран-зиторной гиперпигментацией и/или атрофическими рубцами.
• Также могут наблюдаться макулы, папулы, волдыри/ангиоэдема, пустулы, везикулы, язвы, некроз и сетчатое ливедо.
• Возможны эпизоды рекуррентной и хронической крапивницы и ангиоэдемы.
• Сыпь может возникать на любых участках, однако чаще всего наблюдается на нижних конечностях или связанных с ними участках, например, спине и ягодицах.
• Сыпь может быть связана с заболеваниями соединительной ткани, особенно ревматоидным артритом, синдромом Шегрена, системной красной волчанкой и гипергаммаглобулинемической пурпурой.
• Возможны различные провоцирующие факторы, однако чаще всего это инфекции и препараты.
• Наиболее известная подгруппа идиопатического кожного некротизирующего васкулита у детей — пурпура Шенлейна-Геноха.
• Гистологические критерии включают некроз кровеносных сосудов с отложением фибриноидных веществ и дермальным клеточным инфильтратом, состоящим из нейтрофилов с остатками ядер, мононуклеарных клеток и эритроцитов.
Некротизирующий ангиит, или васкулит, представляет собой разнообразную группу расстройств, при которых сочетается сегментарное воспаление и некроз кровеносных сосудов. Повреждение сосудов может происходить по иммунологическим и/или другим воспалительным механизмам. Клинические синдромы выделяют на основании макроскопических критериев и гистологических изменений при поражении сосудов, калибра кровеносных сосудов, частоты поражения органов и изменений лабораторных данных.
Некротизирующий васкулит может быть первичным заболеванием, развиваться как признак системного расстройства или быть идиопатическим. Стандартная классификация васкулитов отсутствует; широко применяется классификация Американской коллегии ревматологов и критерии согласительной конференции в Chapel Hill. Применение этих классификаций в клинической практике ограничено, так как некоторые болезни в них не включены, в некоторых заболеваниях отмечается совпадение клинических проявлений, а также не хватает точности в описании кожных признаков.
Некротизирующий васкулит кожи в основном поражает венулы и известен как кожный некротизирующий венулит (КНВ), и лейкоцитокластический васкулит. КНВ в сочетании с системным поражением мелких кровеносных сосудов часто называется ангиитом или васкулитом гиперчувствительности, системным полиангиитом и микроскопическим полиангиитом. КНВ может наблюдаться в сочетании с лежащими в его основе хроническими заболеваниями, может провоцироваться инфекциями или препаратами или развиваться по неизвестным причинам . Системные формы некротизирующих васкулитов, поражающих крупные сосуды, рассмотрены в таблице ниже.
а) Эпидемиология кожного некротизирующего васкулита (КНВ). Возраст пациентов в незначительной степени влияет на кожный некротизирующий васкулит (КНВ). Возраст развития заболевания обычно определяется сопутствующим хроническим заболеванием. У детей кожный некротизирующий васкулит (КНВ) чаще всего описывается как пурпура Шенлейна-Геноха, заболеваемость среди лиц младше 17-летнего возраста в Великобритании составляет 20/100000. В Индии кожный некротизирующий васкулит (КНВ) был самым распространенным типом васкулита среди лиц, обращавшихся к дерматологу на амбулаторном приеме.
У пациентов старше 50 лет наиболее распространены васкулиты, связанные с антинейрофильными цитоплазматическими антителами (ANCA). Географические вариации в частоте заболевания могут быть проявлением воздействий окружающей среды, а сезонные вариации, возможно, указывают на инфекционную этиологию.

б) Этиология и патогенез кожного некротизирующего васкулита (КНВ). В экспериментальных исследованиях на животных и наблюдениях у человека было показано, что основной патобиологический механизм развития кожного некротизирующего васкулита включает иммунные комплексы. Согласно данным, полученным на животных, локализация в венулах связана с вазоактивными аминами и последующими изменениями проницаемости сосудов. Дополнительные факторы, которые обусловливают локализацию иммунных комплексов — рецепторы поверхности эндотелиальных клеток и нарушение клиренса иммунных комплексов ретикулоэндотелиальной системы.
Наиболее общепризнанный механизм развития кожного некротизирующего васкулита — отложение циркулирующих иммунных комплексов in situ в коже. Иммунные комплексы могут активировать систему комплемента и приводят к образованию С5а анафилотоксина, который привлекает нейтрофилы, которые в свою очередь высвобождают лизосомальные ферменты, повреждающие ткани. Система образования супероксида в нейтрофилах может вырабатывать активные формы кислорода, которые также разрушают ткани. Образование хемоаттрактантного лейкотриена (LT) В4 инфильтрирующими нейтрофилами усиливает приток нейтрофилов. Инфильтрат, в основном состоящий из нейтрофилов в поврежденных тканях при КНВ, обусловлен разрушением тканей иммунными комплексами, которые активируют систему комплемента.
Во время первоначального нейтрофильного процесса клеток CD3, CD4, CD1a и CD36 имеется мало, но в поздней фазе их количество значительно возрастает и выражены адгезивные рецепторы молекул межклеточной адгезии-1(IСАМ-1) и связанный с лимфоцитарной функцией антиген-1 (LFA-1). При синдроме Шенлейна-Геноха фрагментацию нейтрофилов объясняли апоптозом — на основании выявления индуцибельной NO-синтазы и нитротирозина в инфильтрате, а также интерлейкина 8 на эндотелиальных клетках сосудов. Длительная пенетрация РТХЗ, вследствие которой блокируется фагоцитоз апоптотических нейтрофилов макрофагами, обнаружена в образцах биопсии пациентов с идиопатическим кожным некротизирующим васкулитом и пурпурой Шенлейна-Геноха вокруг кровеносных сосудов и на участках инфильтратов с лейкоцитоклазией.
У пациентов с кожным некротизирующим васкулитом в крови были обнаружены циркулирующие иммунные комплексы в виде криоглобулинов смешанного типа, а также Cёq преципитины, вещества, которые связываются с рецепторами комплемента на лимфоцитоидных клетках (Raji). Кроме этого были выявлены вещества, связывающиеся с моноклональным ревматоидным фактором, а также вещества, действующие в антитело-зависимой пробе клеточной цитотоксичности. Вывод о присутствии иммунных комплексов основан на гипокомплементемии с активацией по классическому пути и выявлении повышенного уровня анафилотоксинов С4а и С3а.
Ультраструктурное наблюдение очаговых тканей при КНВ выявило наличие иммунных комплексов в форме электронно-плотных субэндотелиальных отложений; мембраноатакующий комплекс, С5b-9, системы комплемента обнаружен на поверхности эндотелиальных клеток и инфильтрирующих нейтрофилов. DAT-фактор (стимулятор гемолиза), регуляторный белок комплемента, предотвращающий сборку атакующего мембрану комплекса, не представлен на поверхности эндотелиальных клеток в сосудах верхнего слоя дермы. Иммунные комплексы в тканях также были обнаружены прямыми методами иммунофлуоресценции в виде отложений иммуноглобулинов и белков комплемента. В исследованиях развития кожных очагов поражения сосудов иммунные реактанты были выявлены в очагах, появившихся менее 24 часов назад.
Антигены были обнаружены лишь в ряде случаев, это были бактериальные, вирусные, микобактериальные или риккециозные белки, выявленные иммунофлуоресцентными методами или полимеразной цепной реакцией.
О роли лимфоцитов, мононуклеарных клеток и клеток Лангерганса в развитии кожного некротизирующего васкулита свидетельствует перивенулярный инфильтрат в очагах поражения кожи, богатый лимфоцитами с крупными и гиперхроматическими ядрами, а также преобладание мононуклеарных клеток в очагах поражений сосудов кожи пациентов с кожным некротизирующим васкулитом и синдромом Шегрена. Лимфоциты экспрессируют CD3, CD4, CD1a, CD36, молекулу межклеточной адгезии-1 и антиген, связанный с функцией лимфоцитов-1. Лимфоциты могут быть активированы иммунными комплексами, клеточными иммунными механизмами или первичной активацией при аутоиммунных заболеваниях, после чего они начинают выделять лимфокины.
При реакциях клеточного иммунитета, в случае лимфоцитарного васкулита, поддержанию кожного некротизирующего васкулита способствуют дендритные клетки и лимфоциты. При кожном некротизирующем васкулите повышено количество экспрессирующих фактор ХIIIа+ дендроцитов, которые участвуют в презентации антигенов Т-клеткам. Эндотелиальные клетки также могут презентировать антигены Т-лимфоцитам и активировать их. Активированные макрофаги выделяют хемокины и лизосомальные ферменты. Т-клетки γ/β были обнаружены при кожном некротизирующем васкулите с выявленной инфекционной этиологией и преобладанием нейтрофилов. В этих пробах эндотелиальными клетками и антиген-презентирующими клетками экспрессировались белки теплового шока массой 72 кДн.
Участие тучных клеток в кожном некротизирующем васкулите подтверждается гипогранулированными тучными клетками с опорожненными внеклеточными гранулами, уменьшенным количеством тучных клеток в биопсийных пробах очагов в коже, а также развитием сосудистых поражений после внутрикожных инъекций гистамина пациентам с обострением кожного некротизирующего васкулита. Тучные клетки могут быть активированы непосредственно иммунными комплексами через рецептор FcγRIII или фрагментами комплемента, действующими через их специфические рецепторы.
За счет выделения гистамина, простагландина D2 и цистениловых лейкотриенов тучные клетки могут менять проницаемость сосудов; в венулах пациентов с КНВ обнаружены промежутки между эндотелиальными клетками. Факторы хемотаксиса, выделяемые тучными клетками, могут привлекать эозинофилы и нейтрофилы. Нейтральные протеазы и кислые гидролазы тучных клеток могут повреждать ткани, а выделение фактора некроза опухоли (ФНО)-α может усиливать экспрессию Е-селектина на эндотелиальных клетках, привлекая нейтрофилы.
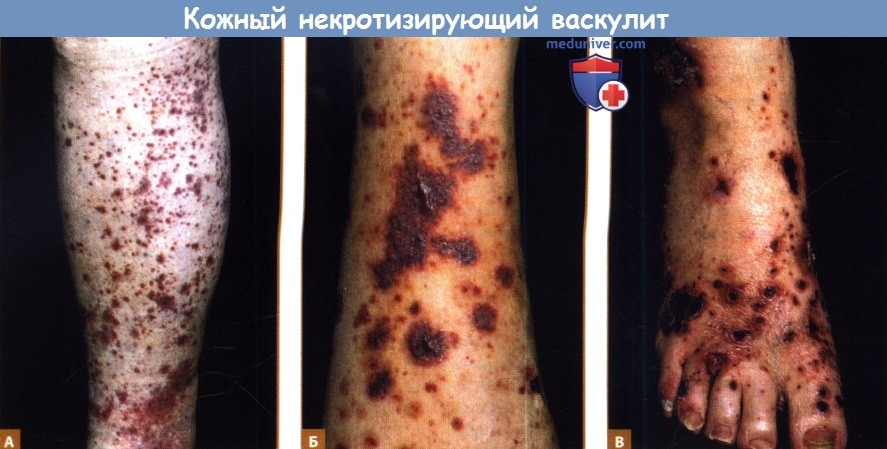
Б. Пальпируемая пурпура с выраженным повреждением тканей, что вызывает образование пузырей и булл.
В. Еще более выраженное повреждение тканей, множественный некроз и язвы.
Доказательства роли тучных клеток получены в ходе анализа последовательных гистопатологических изменений при клинической картине крапивницы. У пациентов с циркулирующими иммунными комплексами и гипокомплементемией, обострения которых провоцируются холодом и травмой, после начальной дегрануляции тучных клеток наблюдалась инфильтрация нейтрофилами с притоком эозинофилов и базофилов, отложением фибрина и некрозом эндотелиальных клеток венул. Предполагаемая последовательность событий — активация тучных клеток физическими стимулами, выделение вазоактивных медиаторов, отложение циркулирующих иммунных комплексов с активацией системы комплемента, приток нейтрофилов и развитие КНВ.
Другой пример течения некротизирующего венулита в коже человека был обнаружен при васкулите, вызванном нагрузкой. Через три часа количество тучных клеток снижалось и вокруг венул появлялись эозинофилы с отложениями эозинофильной пероксидазы. Содержание ФНО-α было повышено, на эндотелиальных клетках экспрессировался Е-селектин и впоследствии наблюдался приток нейтрофилов с отложением нейтрофильной эластазы и развитием КНВ.
На ранних этапах некротизирующего венулита в эндотелиальных клетках наблюдалась повышенная экспрессия молекулы межклеточной адгезии-1 и Е-селектина без экспрессии сосудистой молекулы межклеточной адгезии (VCAM)-1 в ответ на ФНО-α. Поскольку Е-селектин — молекула адгезии для нейтрофилов и для Т-клеток памяти, характеризующихся хомингом в кожу, повышение содержания Е-селектина приводит к инфильтрации нейтрофилов, которые экспрессируют CD11b в первые 24 часа.
В острой фазе пурпуры Шенлейна-Геноха были повышены уровни эндотелина-1, сывороточного инсулиноподобного фактора роста-1 (IGF-1), IGF-связывающего белка-3, плазменной матричной металлопротеиназы 9(MMP-9), ICAM-1,VCAM-1, ФНО-α, ИЛ-1-β, рецептора ИЛ-2, интерлейкинов ИЛ-6, ИЛ-8, трансформирующего фактора роста-(3, фактора роста клеток сосудистого эндотелия (VEGF) и лейкотриена мочи Е4, а уровень индуцируемого интерфероном-γ белка был низким. Однако патогенетическая роль этих медиаторов не выяснена. IgA-антитела к клеткам эндотелия связываются с эндотелиальными клетками и повышают производство в них интерлейкина ИЛ-8 посредством механизмов митоген-активированной протеинкиназы (МЕК)/внеклеточной сигнально-регулируемой киназы (ERK).
В биоптатах кожи пациентов с идиопатическим кожным васкулитом, васкулитом, связанным с гиперчувствительностью, уртикарным васкулитом и синдромом Шенлейна-Геноха, Е-селектин обнаруживался на эндотелиальных клетках в высыпаниях с давностью менее 48 часов и был связан с инфильтратом нейтрофилов, экспрессирующих CD11b. Эндотелиальные клетки экспрессировали HLA-DR и очень поздний активирующий антиген-1, но не Р-селектин; периваскулярные клетки содержали VCAM-1 и HLA-DR. У пациентов с КНВ наблюдалась сниженная кожная фибринолитическая активность с уменьшением выделения активатора плазминогена из эндотелиальных клеток венул; последующее уменьшение фибринолитической активности приводит к отложению фибрина. При пурпуре Шенлейна-Геноха повышается содержание в плазме тромбомодулина, активатора плазминогена тканевого типа и ингибитора активатора плазминогена-1.
Кожные нервные окончания могут выделять нейропептиды, например, вещество Р, нейрокинин А и пептид, связанный с геном кальцитонина, которые вызывают вазодилятацию. Вещество Р активирует тучные клетки и макрофаги, а также повышает фибринолитическую активность, вызванную активатором плазминогена. Пептид, связанный с геном кальцитонина, вызывает экспрессию Е-селектина на эндотелиальных клетках и вызывает хемотаксис лимфоцитов.
Эозинофилы не относятся к преобладающим инфильтрирующим клеткам при кожном некротизирующем васкулите (КНВ), за исключением эозинофильного васкулита и медикаментозного кожного некротизирующего васкулита. Эозинофилы могут выделять LTC4 и фактор активации тромбоцитов, повышающей проницаемость сосудов. Белки эозинофильных гранул токсичны для клеток эндотелия и вызывают выделение химических медиаторов тучных клеток.
Была обнаружена связь между некротизирующим васкулитом мелких сосудов и ANCA, которые специфичны для белков цитоплазматических гранул нейтрофилов и лизосом моноцитов. Известны две формы: (1) цитоплазматические антитела(с-ANCA), направленные против протеиназы 3 (PR3) и (2) перинуклеарные антитела (p-ANCA), направленные против миелопероксидазы (МРО). ФНО-α способствует активизации нейтрофилов и экспрессии PR3 и МРО на клеточной поверхности, которые затем связываются с ANCA и усиливают прилипание нейтрофилов к эндотелиальным клеткам, что приводит к их повреждению. Антитела к эндотелиальным клеткам были выявлены в сыворотке пациентов с системным васкулитом, ревматоидным артритом с васкулитом, микроскопическим полиангиитом и синдромом Снеддона.
Преобладание HLA гаплотипа HLA-A11, Bw35 при кожном некротизирующем васкулите (КНВ), связанных с расстройствами соединительной ткани, свидетельствует о возможном влиянии генетических факторов.
- Рекомендуем далее ознакомиться со статьей "Симптомы и клиника кожного некротизирующего васкулита"
Редактор: Искандер Милевски. Дата публикации: 18.2.2019

