Причины и механизмы развития реактивного артрита. Этиология и патогенез
- Реактивный артрит является одним из спондилоартритов. Это воспалительный синдром, который в типичных случаях манифестирует спустя 1-4 недели после мочеполовой или желудочно-кишечной инфекции.
- Для большинства пациентов «классическая триада» симптомов (синовит, уретрит и конъюнктивит) не характерна, однако часто могут быть вовлечены другие органы, в частности кожа.
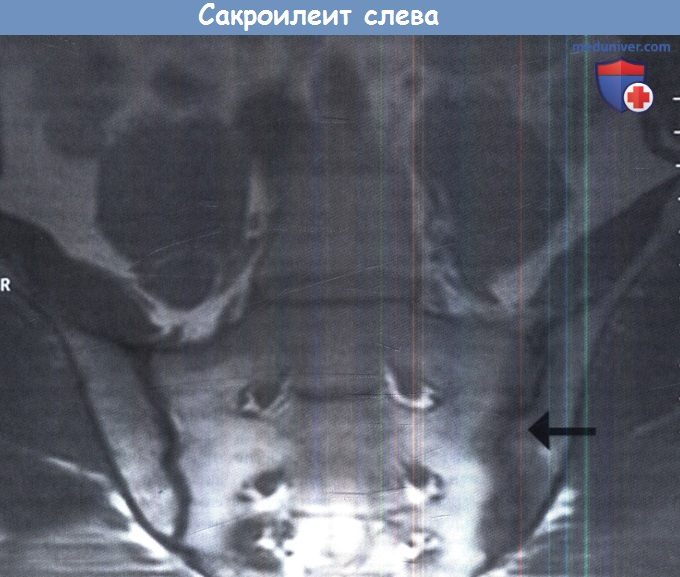
- Ключевыми клиническими проявлениями заболевания являются: ассиметричный артрит нескольких суставов (чаще всего — крупных суставов нижних конечностей), который часто сопровождается артритом осевого скелета и энтезитом ахиллова сухожилия, подошвенной фасции или крестцово-подвздошного сочленения.
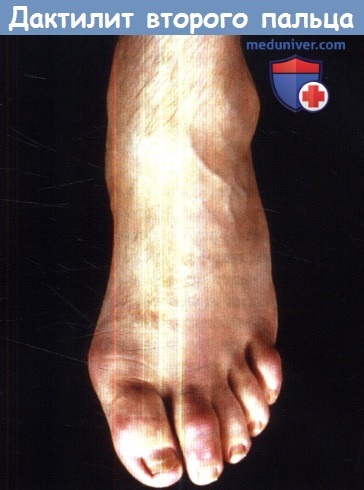
- Псориазиформные высыпания на ступнях (бленнорейная кератодермия) или половом члене (круговидный баланит) встречаются примерно у одной трети пациентов. Воспалительное поражение глаз отмечается также примерно у трети всех больных. Уретрит может развиться как в присутствие мочеполовой инфекции, так и без нее.
- HLA-B27 увеличивает уязвимость к реактивному артриту и способствует хронификации заболевания. Однако согласно более современным данным HLA-B27 является фактором риска более тяжелых симптомов заболевания, выступая таким образом в качестве вмешивающегося фактора, вносящего систематическую ошибку в процесс диагностки.
- Chlamydia, Salmonella, Campylobacter, Shigella и Yersinia являются микроорганизмами, достоверно взывающими реактивный артрит, однако многие другие инфекционные агенты также могут играть роль инициирующих агентов.
- Хотя чаще всего реактивный артрит проходит в течение недель или месяцев, не менее чем у 30-50% больных заболевания переходит в хроническую форму с обострениями и ремиссиями.
а) Микроорганизмы как причины реактивного артрита. Бактериями, часто вызывающими реактивный артрит являются Salmonella, Shigella, Campylobacter, Yersinia и Chlamydia trachomatis. Действительно, данные микроорганизмы выступают в качестве достоверных триггеров, провоцирующих реактивный артрит, однако и многие другие инфекционные агенты также могут быть задействованы в качестве потенциальных этиологических факторов. Chlamydia trachomatis — это этиологический фактор, наиболее часто вызывающий реактивный артрит в США.
Несмотря на очевидные различия в плане инициального источника инфекции (т.е. желудочно-кишечный или через мочеполовой тракт), существуют и другие отличительные особенности реактивных артритов. Так, постдизентерийная форма реактивного артрита всегда развивается вслед за клинически выраженной инфекцией, и по последним данным, чем тяжелее протекает первичная желудочно-кишечная инфекция, тем более вероятно развитие реактивного артрита. В то же время первичное заражение Chlamydia trachomatis часто протекает асимптоматически, что и подтверждают современные сведения о том, что бессимптомное инфицирование Chlamydia trachomatis является частой причиной реактивного артрита.
В упомянутом исследовании показано, что у большинства пациентов с диагнозом недифференцированного спондилоартрита, несмотря на отсутствие данных о наличии инфекции до развития артрита, в синовиальной ткани путем ПЦР обнаруживаются хламидии. Данные результаты согласуется с тем, что у 78% пациентов, заболевших реактивным артритом после заражения венерической инфекцией, последняя протекала асимптоматически. Большое количество опубликованных исследований свидетельствует, что Chlamydophila (Chlamydia) pneumonaie (Срп), родственный Chlamydia trachomatis патоген респираторного тракта, является еще одним этиологическим фактором реактивного артрита, хотя заболевание ассоциировано с этим микроорганизмом реже.
Хламидии являются грамотрицательными облигатными внутриклеточными паразитами. Частота развития реактивного артрита после инфицирования хламидиями составляет приблизительно 5%. Анализ синовиальной ткани пациентов, страдающих постхламидийным реактивным артритом, показал, что хламидии перемещаются из места первоначального инфицирования в синовиальные оболочки.
Эти синовиальные хламидии существуют в морфологически аберрантном, но метаболически активном состоянии, которое называют хламидийным персистированием. Экспрессия генов у таких хламидий весьма снижена и существенно отличается от характерной для активного инфекционного процесса. К примеру, во время персистирования хламидий экспрессия гена главного протеина наружной мембраны (omp 1) и нескольких генов, необходимых для процесса деления клетки, существенным образом подавлена. Эти процессы сопровождаются дифференцированной регуляцией трех паралог-генов, ответственных у хламидий за синтез белков теплового шока (HSP) -60 [(1) Ct110, (2) Ct604, и (3) Ct755].
Точная роль хламидий, персистирующих в синовиальных оболочках, в патогенезе и утяжелении течения заболевания до сих пор окончательно не определена. Однако необходимо заметить, что доказано перемещение аналогичных персистирующих хламидий в другие органы, в частности кожу у пациентов с вероятной бленнорейной кератодермией.
Дополнительные новые данные, касающиеся хламидийного реактивного артрита, заставляют нас пересмотреть традиционные взгляды. Так как эти патогенные организмы ответственны за мочеполовую инфекцию, было бы логично предположить, что именно генитальные штаммы С. trachomatis провоцируют реактивный артрит. Однако существует много сероваров С. trachomatis, в частности серовары от А до К. Серовары А, В и С являются глазными (вызывают трахому), в то время как остальные (от D до К) — генитальными. Необходимо отметить последнее исследование, в котором оценивались серовары пациентов с установленным диагнозом реактивного артрита, провоцированного С. trachomatis.
В этом исследовании было показано, что все 36 образцов синовиальной ткани оказались позитивными в отношении глазных, а не генитальных сероваров. Известно, что генитальная инфекция, вызванная глазными сероварами существует, однако редко. Невысокая частота мочеполовых инфекций, обусловленных глазными штаммами, может объяснить низкую частоту приступов реактивного артрита среди пациентов с острыми хламидийными инфекциями.
Микроорганизмы, провоцирующие развитие реактивного артрита:
1. Достоверно провоцирующие:
а) Поственерические. Chlamydia trachomatis.
б) Постэнтеритические:
- Salmonella (S. enteritidis, S. typhimurium, S. bovismorbificans, S. blockley)
- Shigella (S. flexneri, S. dysenteriae, S. sonnei, S. boydii)
- Campylobacter (C. jejuni, C. coli)
- Yersinia (Y. enterocolitica, Y. pseudotuberculosis)
2. Вероятно провоцирующие:
- Chlamydophila (Chlamydia) pneumoniae
- Ureaplasma urealyticum
- Bacille Calmette-Guerin (интраваскулярно)
3. Возможно провоцирующие:
- Bacillus cereus
- Brucella abortus
- Clostridium difficile
- Escherichia coli
- Helicobacter pylori
- Hafnia alvei
- Lactobacillus
- Neisseria meningitidis serogroup В
- Pseudomona
- Кишечные паразиты (Strongyloides stercolis, Taenia saginata, Giardia lamblia, Ascaris lumbricoides, Filariasis и Cryptosporidium)
4. Другие микроорганизмы, которые могут играть роль в развитии воспалительных артритов:
- Borrelia burgdorferi (болезнь Лайма)
- Propionbacterium acnes (синдром SAPHO)
- Streptococcus sp. (постстрептококковый реактивный артрит)
- Trophyrema whippelii (болезнь Уипла)
б) Факторы организма-хозяина приводящие к реактивному артриту. Реактивный артрит представляет собой классический пример взаимодействия между организмом-хозяином и окружающей средой. Факторы окружающей среды играют несомненную роль в развитии заболевания. Концепция бактериального персистирования также подтверждает точку зрения, согласно которой эти патогенные факторы играют роль не только в развитии, но и прогрессировании, а также сохранении этого заболевания. Определенные серовары или виды бактерий могут быть особенно артритогенными или более склонными к диссеминации. В то же время генетическая предрасположенность играет не менее существенную роль. Так как реактивный артрит является одним из вариантов спондилоартрита, большое внимание в отношении генетики организма-хозяина уделялось HLA-B27. Кроме того, существуют данные, что больные, инфицированные ВИЧ, более уязвимы в отношении развития реактивного артрита, а выраженность его симптомов достоверно снижается после проведения антиретровирусной терапии.
Распространенность HLA-B27 и реактивных артритов варьирует в разных страна мира. В популяции европеоидов HLA-B27 представлен с частотой 7-9%. В старой литературе есть указания, что 70-80% пациентов с реактивным артритом являются HLA-B27 позитивными. Однако в нескольких крупных эпидемиологических исследованиях реактивных артритов было показано, что лишь 30-50% пациентов позитивны в отношении этого антигена. Более новые данные свидетельствуют в пользу того, что может не быть никакой связи между реактивным артритом и HLA-B27. Большинство данных, посвященных распространенности HLA-B27 среди больных реактивным артритом, получено в результате эпидемиологических исследований, выполненных на примере постдизентерийных артритов, развившихся вслед за острой вспышкой кишечного заболевания. Тем самым, реальная распространенность HLA-B27 при постхламидийных артритах остается менее определенной.
Возможно, что HLA-B27 в большей степени оказывает модифицирующее влияние на течение заболевания, нежели является генетическим локусом уязвимости. В нескольких исследованиях, посвященных реактивным артритам, было показано, что позитивные в отношении HLA-B27 пациенты имели более тяжелые симптомы, что свидетельствует в пользу способности HLA-B27 утяжелять клиническую картину. Указанный гаплотип также может повышать риск развития полной триады симптомов. Также необходимо отметить, что различия в распространенности HLA-B27 в указанных исследованиях могут быть, по крайней мере, отчасти объяснены потенциальной ролью, которую играет HLA-B27 в формировании фенотипа. Цитированные выше исследования показали, что HLA-B27 оказывает незначительное влияние (или совсем не влияет) на подверженность заболеванию среди пациентов с мягкими, маловыраженными симптомами, в то время как в прошлых исследованиях, свидетельствующих в пользу большей распространенности положительных HLA-B27 пациентов, включались больные с более тяжелыми формами заболевания, иногда обнаруживающие полную триаду.
Вне зависимости от того, увеличивает ли HLA-B27 восприимчивость к реактивному артриту или влияет на клиническую картину, HLA-B27 совершенно точно играет роль в развитии реактивного артрита. Существует много теорий, посвященных патофизиологической роли HLA-B27, однако ни одна из них не доказана. Так как HLA-B27 относится к первому классу антигенов гистосовместимости, предполагалось, что HLA-B27 презен-тирует артритогенные микробные пептиды Т-клеткам, стимулируя аутоиммунный ответ, так называемую молекулярную мимикрию. И наоборот, HLA-B27 сам по себе может выступать в качестве аутоантигена, на который направлены действия иммунной системы.
Также возможно, что экспозиция провоцирующими артрит микроорганизмами может нарушать аутотолерантность по отношению к собственным В27 антигенам. Еще одна теория постулирует, что роль HLA-B27 состоит в усилении инвазии вызывающих артрит микроорганизмов в эпителиальные клетки человеческого организма у пациентов с постдизентерийным реактивным артритом. Большое количество данных свидетельствует, что нарушения конформации HLA-B27 может вести к ответу неверно упакованного белка, ведущему к усилению продукции интерлейкина-23. В то же время этот ответ белка с нарушенной третичной структурой связан не только с реактивным артритом. HLA-B27 имеет многочисленные аллели, которые могу влиять на ответ организма хозяина и уязвимость к заболеванию. В одном исследовании было показано, что хотя HLA-B*2705 является наиболее частым аллелем среди В27-позитивных пациентов с реактивным артритом, он наблюдается в этих случаях реже, чем при других спондилоартритах и среди В27-позитивных здоровых лиц.
Хотя HLA-B27 играет важную роль в патогенезе реактивного артрита, это не единственная детерминанта, определяющая развитие данного заболевания. Очевидно, что НХА-В27-негативные пациенты также могут заболеть реактивным артритом. Предполагается, что HLA-B*5703 повышает риск формирования классической триады симптомов у пациентов, которые заболевают реактивным артритом. Анализ экспрессии генов позволяет предположить, что проангиогенные факторы способствуют генетической уязвимости к реактивному артриту. Значительно больше предстоит узнать о других локусах HLA или даже о роли генов, не относящихся к HLA, которые также могут играть существенную роль в развитии реактивного артрита.
в) Патофизиология реактивного артрита. Очевидно, что микроорганизмы, вызывающие реактивный артрит, расположены (либо полностью, либо некоторая их часть) внутриклеточно, когда выходят из места первичного инфицирования и перемешаются по направлению к синовиальным оболочкам. Однако чем регулируется этот процесс, еще не ясно. Также до конца не известно, является ли присутствие микроорганизмов в органах-мишенях триггером развития воспалительного процесса или эти микроорганизмы сами по себе выступают в качестве источника воспаления. По-видимому, процесс поглощения микроорганизмов иммунными клетками организма, их перемещение и толерантность организма хозяина являются мультифакториальными по своей природе.
Хотя организмы, вызывающие артрит, являются внутриклеточными паразитами, процесс их захвата иммунными клетками до сих пор остается не полностью очевидным. Не вызывает сомнений, что процессы захвата каждого из внутриклеточных паразитов являются практически уникальными. В случае с хламидиями попытки найти специфический внеклеточный лиганд оказались безуспешными. Недавно были получены интригующие предварительные данные, что может не быть специфического хламидийного лиганда, и данные патогенные микроорганизмы могут полностью полагаться только на различные чужие лиганды. Так, аполипопротеии Е (АроЕ4) связывается с поверхностью элементарных телец хламидий и за счет сродства к семейству рецепторов липопротеинов низкой плотности клеток организма хозяина увлекает хламидии за собой. Однако это верно лишь в отношении С. pneumoniae, но не С. trachomatis. В случае сальмонелл закрепление этих микроорганизмов на клетках хозяина обеспечивают фимбрии первого типа, что и способствует их внедрению в организм.
Толл-подобные рецепторы (Toll-like receptors — TLR) являются ключевым компонентом врожденного иммунитета. Так как они находятся на первой линии защиты организма от чужеродных микробов и распознают внеклеточные патогены, они могут играть роль в формировании реактивных артритов. Все достоверно вызывающие реактивный артрит микроорганизмы являются грамотрицательными с липополисахаридным комплексом на поверхности клеточной стенки, a TLR-4 распознает липополисахариды. Мыши с дефицитом TLR-4 при инфицировании сальмонеллами демонстрируют ускоренный рост бактерий и преждевременную смерть. Другие исследования на животных показали, что эффективная очистка организма от хламидий обусловлена достаточной экспрессией TLR-4 на поверхности нейтрофилов. В то же время, исследования на людях показали, что уязвимость к реактивному артриту после инфицирования сальмонеллами определяется не TLR-2, a TLR-4.
Что касается цитокинового ответа при ревматоидном артрите, важную роль играют как Th1, так и Th2, однако патогенетический путь Th2 преобладает. Хотя для больных реактивным артритом характерен более высокий уровень фактора некроза опухоли TNF-a (Тh1), чем для здоровых людей, он ниже, чем при других формах воспалительных артритов. Анализ синовиальной жидкости пациентов с реактивным артритом показал повышение уровня IL-10 и понижение TNF-a и IFN-y (это свидетельствует в пользу преобладания Th2). Любопытно, что при постхламидийном артрите снижение уровня этих двух цитокинов (TNF-a и IFN-y) ассоциировано с повышением репликации хламидий и общим увелечением количества этих микроорганизмов in vitro. Супрессия цитокинов ТЫ вероятнее всего реализуется через подавление синтеза IL-12.
Также существуют данные в пользу того, что уровень цитокинов со временем меняется. Больные реактивным артритом с длительностью течения заболевания больше шести месяцев синтезируют достоверно меньше TNF-a. Временная взаимосвязь между балансом различных видов Тh1 и Th2 цитокинов может быть важна в отношении клинических проявлений заболевания. Незначительные изменения в балансе между Тh1 и Th2 могут обуславливать обострения реактивного артрита, которые часто наблюдаются при хроническом течении заболевания. Исследования на животных показали, что ослабление первоначального цитокинового ответа TNF-a, IFN-y и интерлейкина-4 (Il-4) на острую хламидийную инфекцию ведет к уменьшению бактериального клиренса. Тем самым, слабый первоначальный ответ Th1 цитокинов ведет к увеличению вероятности развития реактивного артрита. Эти полученные на животных данные соотносятся с тем фактом, что асимптоматические хламидийные инфекции у людей часто приводят к развитию реактивного артрита.
- Рекомендуем далее ознакомиться со статьей "Симптомы и клиника реактивного артрита"
Оглавление темы "Реактивный артрит.":
