Анализы для диагностики лейшманиоза
С учетом потенциальной токсичности заболевания подтверждение диагноза всегда является обязательным. Даже после анализа мазков, гистологии и посева на культуру в совокупности, в 10-20% случаев паразита обнаружить не удается. Диагностика еще более усложняется при заболеваниях Нового Света и в случае хронических очагов. Чувствительность анализа тканевых мазков и посева достигает 90%, если пробы берутся в первые недели инфекции. Лучше всего использовать несколько диагностических методов.
Биопсию кожи, взятую из инфильтрированного края очага, можно разделить на три части: одну для мазка-отпечатка, вторую для гистологического исследования и третью для посева.
Можно применять несколько способов исследования мазков со степенью успеха от 50% до 80%. Мазки берутся методом тонкоигольной аспирации или соскобами ткани, высушиваются на воздухе, фиксируются метиловым спиртом, окрашиваются по Гимзе и исследуются под микроскопом с масляной иммерсией. Мазки-отпечатки, получаемые при легком 2-5 кратном прижатии биоптата кожи к предметному стеклу, обеспечивают лучшую чувствительность, чем окрашивание гематоксилином и эозином.
При патогистологическом исследовании ранних очагов LCL, выявляется плотный и диффузный смешанный воспалительный клеточный инфильтрат, состоящий преимущественно из гистиоцитов и рассеянных гигантских многоядерных клеток, лимфоцитов и плазматических клеток (иногда с гомогенным эозинофильным, содержащим иммуноглобулин материалом внутри цитоплазмы, так называемыми тельцами Русселя).
Ведущим признаком заболевания (примерно в 70% случаев) является присутствие многочисленных внеклеточных и внутриклеточных (в гистиоцитах) амастиготов (известных также как тельца Лейшмана-Донована), Краситель Гимзы не дает метахроматического окрашивания паразитов, кинетопласт становится ярко-красным. Возбудителей можно также обнаружить окрашиванием по Райту и Фельгену. Моноклональные антитела, такие как G2D10, способны идентифицировать амастиготы и промастиготы в мазке, биопсии или посеве, их применение является быстрым скрининговым тестом на лейшманиоз. Гистологический дифференциальный диагноз включает заболевания, для которых характерно присутствие паразитарных макрофагов.
Наличие ободка вкруг дрожжевых организмов при гистоплазмозе, а также напоминающих булавочную головку инкапсулированных телец Донавана при паховой гранулеме и клеток Микулича при риносклероме отличает эти заболевания от лейшманиоза. К другим возможным заболеваниям относятся бластомикоз, паракокцидиоидомикоз, токсоплазмоз и трипаносомоз. По мере развития очагов количество амастигот в срезе уменьшается, и гистология становится похожей на хронический LCL, при котором преобладающей гистологической картиной является узловатый/диффузный не казеозный туберкулоидный гранулематозный дерматит. Степень гиперплазии и изъязвлений эпидермиса вариабельная. Может наблюдаться рубцевание с выраженной утратой эластических волокон.
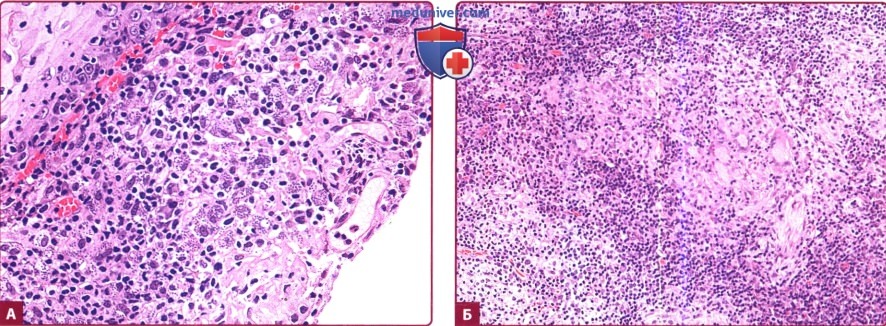
А. Острый кожный лейшманиоз. Лимфогистиоцитарная инфильтрация умеренной плотности, многочисленные макрофаги, содержащие амастиготы (тельца Лейшмана).
Б. Хронический кожный лейшманиоз. Туберкулоидный гранулематозный дерматит. Обращают на себя внимание многоядерные гигантские клетки, лимфоплазмацитарный инфильтрат по периферии и отсутствие паразитов.
Для DCL характерен диффузный инфильтрат в составе вакуолизированных макрофагов с многочисленными внутри- и внеклеточными амастиготами. Основным дифференциальным диагнозом является лепроматозная лепра. При MCL патогистологические признаки такие же, как при LCL, но возбудителей обычно очень мало. Для PKDL характерны эпидермальные микроабсцессы по типу Потрие и плотный лимфоплазматический инфильтрат с отеком сосочкового слоя дермы (в ранних очагах).
Посев культур изучаемого материала (при комнатной температуре) в двухфазную среду, такую как среда NNN (Novy-Mac-Neal-Nicolle) или куриный эмбрион, является золотым стандартом диагностики, но чувствительность составляет только 50%. Посев проводят, используя аспираты, соскобы или материал свежей биопсии кожи. Промастиготы часто появляются через несколько дней, но иногда процесс может занять несколько недель. Определение видов на основе морфологии не представляется возможным.
Молекулярные методы с использованием видоспецифических олигонуклеотидных зондов для ДНК в кинетопластах могут применяться на всех видах образцов. Особенно полезны методы ПЦР, которые обеспечивают превосходную специфичность и чувствительность при диагностике кожного лейшманиоза, MCL и VL, в частности в тех случаях, когда возбудителей очень мало. Широкому применению этих методов препятствует высокая стоимость, а также необходимая для их проведения техническая квалификация. Иногда проблему представляют ложноположительные реакции и идентификация возбудителей кожного лейшманиоза Нового Света.
В настоящее время золотым стандартом для определения специфических видов Leishmania является изоферментный анализ. Он состоит в проведении ферментного электрофореза культивированных промастигот и основан на том, что морфологически похожие промастиготы разных видов имеют различные профили ферментов; однако этот метод длительный и дорогостоящий.
Серология при кожном лейшманиозе бесполезна ввиду низкой чувствительности (титр антител низкий) и специфичности (вследствие перекрестной реакции с лепрой, малярией и другими трипаносомными инфекциями).
В кожном тесте Монтенегро (с лейшманином), аналогичном туберкулиновому тесту, убитые фенолом промастиготы вводятся в дерму. Тест выявляет заражение лейшманиями, но не позволят различить перенесенную и активную инфекцию. Примерно до 50% людей, проживающих в эндемических регионах, могут дать положительную реакцию в тесте без перенесенного или активного заболевания в анамнезе. Тест является положительным после образования корки и отрицательным при энергетических заболеваниях, таких как DCL и PKDL или часто в очагах, существующих менее 3 месяцев.
Инокуляция лабораторных животных (ксенодиагностика) полезна при низкой паразитарной нагрузке. Электронная микроскопия не обладает преимуществом над световой микроскопией и ее применение ограничено.
При VL, диагностическими являются микроскопическое обнаружение и /или выявление паразитов в аспиратах из селезенки (чувствительность >97%), лимфоузлов (чувствительность 60%) или костного мозга (чувствительность 55-97%). Однако поскольку эти способы инвазивные, было разработано несколько серологических и молекулярных методов. Рекомбинантный антиген К39 L. chagasi имеет высокую чувствительность и специфичность. Он применяется в иммунохроматографическом тесте-полоске с использованием полученной уколом в палец крови и помогает в бедных ресурсами регионах. В качестве последнего средства можно применить метод ПЦР на тканевом аспирате или периферической крови, который имеет очень высокую чувствительность.

- Рекомендуем далее ознакомиться со статьей "Современное лечение лейшманиоза и его профилактика"
Редактор: Искандер Милевски. Дата публикации: 30.5.2019

