Механизм развития (патогенез) гломерулонефрита - гломерулопатии
Еще многое неизвестно о причинах и триггерах гломерулопатий, но очевидно, что большинство первичных и многие вторичные гломерулопатий обусловлены иммунными механизмами. Гломерулонефрит в эксперименте легко индуцируется реакцией комплекса антиген-антитело. Кроме того, при гломерулонефритах в большинстве случаев в клубочках выявляют депозиты Ig, часто в сочетании с компонентами системы комплемента. В развитии гломерулонефрита определенную роль могут играть клеточно-опосредованные иммунные реакции в совокупности с механизмами, опосредованными влиянием антител.
Выделяют две формы антитело-опосредованных повреждений клубочка:
(1) повреждения в результате отложений иммунных комплексов in situ;
(2) повреждения, обусловленные отложением в клубочке циркулирующих иммунных комплексов.
Кроме того, в эксперименте показано, что клеточные элементы клубочка могут повреждаться цитотоксическими антителами.
Описанные механизмы патогенеза повреждения почечных клубочков не исключают друг друга, т.е. у человека возможен комбинированный тип повреждений.

а) Гломерулонефрит, обусловленный отложением иммунных комплексов in situ. При этой форме повреждений иммунные комплексы напрямую реагируют с собственными фиксированными (нерастворимыми) антигенами клубочка или антигенами, «осаждающимися» в клубочках из кровотока. Лучшими экспериментальными моделями заболеваний, вызванных антигломерулярными антителами, являются мембранозная нефропатия и гломерулонефрит, индуцированный антителами к БМК (анти-БМК нефрит).
У человека гломерулонефрит, индуцированный антителами к БМК, и мембранозную нефропатию относят к аутоиммунным заболеваниям, обусловленным выработкой антител к компонентам собственных тканей организма. До сих пор неясно, что является пусковым фактором, поскольку установлены несколько механизмов аутоиммунизации. Некоторые формы аутоиммунных гломерулонефритов воспроизводятся в эксперименте при введении химических веществ (например, хлорида ртути), инфекционных агентов (эндотоксинов) и моделировании болезни «трансплантат против хозяина». В этих ситуациях нарушается функция иммунной системы в результате активации В-клеток и выработки антител, реагирующих с антигенами почки.
б) Антитела к собственным антигенам клубочка. Мембранозная нефропатия. После иммунизации крыс антигеном, содержащимся в препаратах щеточной каемки эпителия проксимальных канальцев нефрона, у этих животных развивается заболевание, называемое нефритом Хейманна, напоминающее мембранозную нефропатию у человека. Мембранозная нефропатия характеризуется наличием множественных электронно-плотных депозитов, состоящих преимущественно из компонентов иммунных комплексов и расположенных субэпителиально вдоль базальной мембраны. При иммунофлуоресцентном исследовании депозиты имеют гранулярное строение, а не линейное.
В настоящее время известно, что заболевание обусловлено формированием антител к антигенным детерминантам, расположенным на базальной поверхности висцеральных эпителиальных клеток, и перекрестной реакцией с антигенами щеточной каемки эпителия проксимальных канальцев (эти антигены использовал Хейманн в своих экспериментах).
Крысиный антиген Хейманна — белок мегалин с молекулярной массой 330 кДа — гомологичен рецептору липопротеинов низкой плотности. Соответствующий антиген, обусловливающий развитие мембранозной нефропатии у человека, еще не идентифицирован. Связывание антител с эпителием гломерулярной мембраны вызывает активацию системы комплемента и накопление на клеточной поверхности агрегатов, из которых в дальнейшем формируются характерные субэпителиальные депозиты.
Гломерулонефрит, индуцированный антителами к базальной мембране клубочка. При этой форме повреждений клубочков антитела образуются к антигенным детерминантам нормальных компонентов БМК. Экспериментальной моделью в этом случае является нефрит Мазуги (нефротоксический нефрит), воспроизводимый на крысах путем введения в почечную ткань кроличьих антител. Введенные антитела связываются по всей длине БМК, формируя диффузные непрерывные линейные депозиты антител, в отличие от гранулярных депозитов, выявляемых при нефрите Хейманна или при формировании депозитов из циркулирующих иммунных комплексов.
В нефрите Мазуги вводимые крысе антитела к БМК — это Ig кролика, чужеродный для организма крысы, что приводит к выработке у крысы соответствующих антител. Крысиные антитела взаимодействуют с депозитами Ig кролика, расположенными на БМК, повреждая клубочек. Часто антитела к компонентам БМК перекрестно реагируют с другими базальными мембранами, особенно альвеол легкого, одновременно поражая почки и легкие (синдром Гудпасчера). При гломерулонефрите, индуцированном антителами к БМК, и синдроме Гудпасчера антитела формируются к домену NC1 а3-цепи коллагена типа IV, необходимому для поддержания супраструктуры БМК.
Частота гломерулонефрита, индуцированного антителами к БМК, составляет менее 5% всех случаев гломеруло-нефритов. Большинство наблюдений гломерулонефрита, индуцированного антителами к БМК, сопровождается выраженным повреждением клубочков с формированием полулуний и БПГН.
- Антитела к «осажденным» антигенам. Антитела могут реагировать с антигенами, в норме не присутствующими в клубочке, но задерживаемыми им. Эта теория получает все больше подтверждений в эксперименте. Такие антигены могут находиться в почке и взаимодействовать со структурами клубочка.
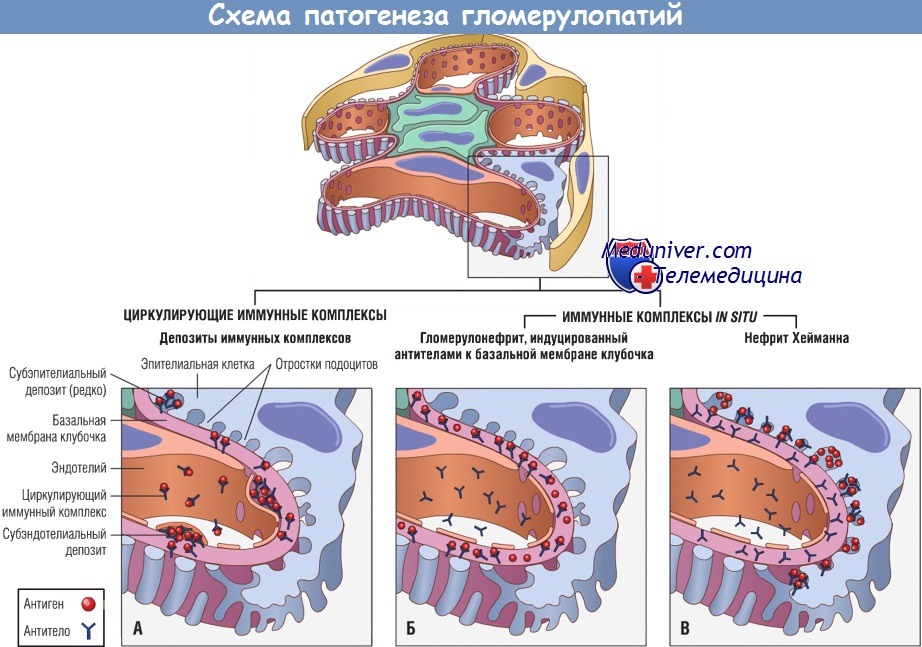
формирующихся in situ, например к компонентам базальной мембраны клубочка (Б) или при нефрите Хейманна (В).
Основными «осажденными» антигенами являются:
(1) положительно заряженные молекулы, связывающиеся с анионными компонентами клубочка;
(2) ДНК, нуклеосомы и другие ядерные белки, которые имеют аффинитет к компонентам БМК;
(3) бактериальные агенты;
(4) крупные комплексы белков (например, агрегаты Ig), которые из-за своего размера откладываются в мезангии;
(5) сами иммунные комплексы с доменами для связывания со свободными антителами, антигенами или компонентами системы комплемента.
Кроме того, существует множество других «осажденных» антигенов, в т.ч. продуктов вирусного, бактериального, паразитарного происхождения и лекарственных веществ. Антитела, связывающиеся с большинством из этих «осажденных» антигенов, индуцируют дискретный характер депозитов Ig, определяемых при иммунофлуоресцентном исследовании как гранулярные и идентичные таковым при нефрите, обусловленном циркулирующими иммунными комплексами.
в) Гломерулонефрит, обусловленный циркулирующими иммунными комплексами. Для этой группы гломерулонефритов характерно повреждение клубочка с отложением в нем циркулирующих иммунных комплексов. При этом антитела не имеют специфических детерминант к компонентам клубочка, а накапливаются в нем из-за своих физико-химических свойств и гемодинамических факторов, специфичных для клубочка.
Патогенез заболеваний, обусловленных иммунными комплексами. В этом разделе мы кратко рассмотрим особенности повреждений клубочков.
Антигены, которые запускают формирование циркулирующих иммунных комплексов, могут быть эндогенными (например, при волчаночном гломерулонефрите) или экзогенными (при гломерулонефрите, развивающемся после некоторых инфекций). К таким антигенам относят компоненты бактерий (как правило, стрептококков), антигены Т. pallidum, Р. falciparum, поверхностные антигены вируса гепатита В, антигены вируса гепатита С и некоторых других вирусов. Кроме того, развитие гломерулонефрита, обусловленного циркулирующими иммунными комплексами, могут вызывать и некоторые опухолевые антигены. Однако во многих случаях провоцирующий антиген остается неизвестным.
Независимо от природы антигена иммунные комплексы формируются в кровотоке, а затем оседают в клубочке, где и вызывают повреждение. Долгое время считали, что повреждение индуцируется и усиливается при связывании компонентов системы комплемента, однако недавние исследования на чистых линиях мышей доказали также участие Fc-рецепторов лейкоцитов и, возможно, клеток почек как активаторов процесса повреждения. Повреждение клубочков обычно сопровождается лейкоцитарной инфильтрацией и пролиферацией мезангиальных и эндотелиальных клеток. При электронной микроскопии иммунные комплексы выявляются как электронно-плотные депозиты в мезангии, между эндотелиальными клетками и БМК (субэндотелиальные депозиты) или между наружной поверхностью БМК и подоцитами (субэпителиальные депозиты). Депозиты могут располагаться сразу в нескольких местах.
При иммунофлуоресцентном исследовании иммунные комплексы выявляются как гранулярные депозиты вдоль БМК, в мезангии или в обоих местах. При накоплении в почке иммунные комплексы могут подвергнуться деградации главным образом нейтрофилами и моноцитами/макрофагами, мезангиальными клетками и эндогенными протеазами, что сопровождается воспалительной реакцией. Такое развитие процесса характерно при небольшом количестве и коротком времени воздействия антигена, что, как правило, наблюдается при постстрептококковом гломерулонефрите. Однако в случае длительной персистенции антигена, например при СКВ или вирусных гепатитах, возможно повторное формирование и отложение иммунных комплексов с последующим повреждением клубочков. Это приводит к развитию хронического мембранозного или мембранопролиферативного гломерулонефрита.
Расположение антигена, антитела или их комплекса в клубочке зависит от нескольких факторов. Крайне важным является заряд и размер молекул антигенов и антител. Положительно заряженные молекулы проходят через БМК, в итоге формирующиеся комплексы располагаются субэпителиально. Отрицательно заряженные иммунные комплексы вымываются из БМК и могут осаждаться субэндотелиально, вызывая заболевание. Нейтрально заряженные молекулы и иммунные комплексы, содержащие их, могут накапливаться в мезангии. Крупные циркулирующие иммунные комплексы обычно не повреждают клубочек, т.к. захватываются фагоцитарной системой и не накапливаются в БМК в достаточном количестве. Локализация депозитов также определяется особенностями гемодинамики в клубочках, функцией мезангия и сохранностью избирательной функции гломерулярного фильтрационного барьера.
Перечисленные факторы могут лежать в основе разных форм гломерулонефритов. Различная локализация иммунных комплексов в клубочке — ключевой фактор реакции клубочка на повреждение и возникающих при этом гистологических особенностей.
г) Антитела к антигенам клеток клубочка. Антитела к антигенам клеток клубочка могут реагировать с компонентами клеток и вызывать цитотоксические и другие повреждения. Например, антитела к антигенам мезангиальных клеток могут вызвать мезангиолизис с последующей пролиферацией мезангиальных клеток; антитела к антигенам эндотелиальных клеток обусловливают эндотелиальные повреждения и тромбоз сосудов; антитела к некоторым антигенам висцеральных эпителиальных клеток у экспериментальных животных обусловливают протеинурию. Этот механизм может играть определенную роль в некоторых иммунных нарушениях у человека в отсутствие депозитов иммунных комплексов при иммунофлуоресцентном исследовании.
В заключение следует отметить, что большинство гломерулонефритов у человека — результат отложения в мезангии или вдоль БМК дискретных иммунных комплексов, выявляемых с помощью иммунофлуоресцентного исследования. Однако бывает сложно определить, формируются ли депозиты циркулирующих иммунных комплексов или депозиты in situ либо участвуют оба механизма, т.к. отложение циркулирующих иммунных комплексов может привести к формированию в дальнейшем и депозитов in situ. Некоторые этиологические агенты, например вирусы гепатита В и С, могут обусловливать развитие мембранозной нефропатии (при накоплении депозитов in situ) и мембранопролиферативного гломерулонефрита (МПГН), более характерного для отложений циркулирующих иммунных комплексов. Таким образом, отложение иммунных комплексов в клубочке — важнейшее звено патогенеза гломерулярных повреждений.
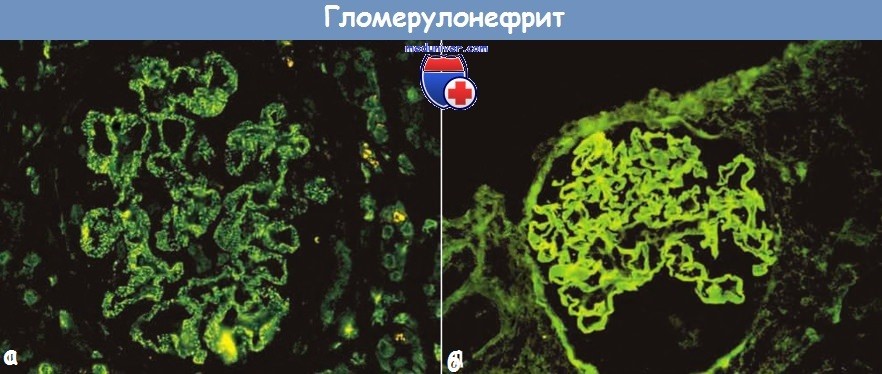
обусловленном циркулирующими иммунными комплексами и иммунными комплексами in situ (иммунофлуоресцентное исследование).
(Б) Диффузные непрерывные линейные депозиты иммунных комплексов,
характерные для гломерулонефрита, индуцированного антителами к базальной мембране клубочка (иммунофлуоресцентное исследование).
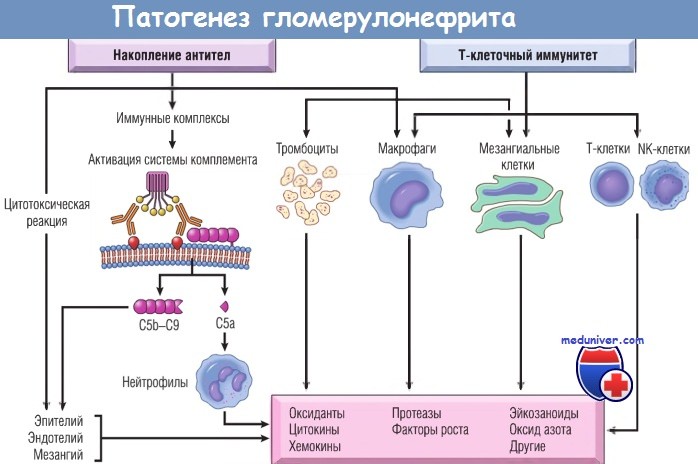
д) Клеточный иммунитет. В настоящее время установлено, что важную роль в прогрессировании многих гломерулонефритов также играет повреждение клубочков, вызываемое сенсибилизированными Т-клетками. Значение активации иммунной системы подтверждается:
(1) выявлением активированных макрофагов, Т-клеток и их продуктов в клубочках при некоторых формах гломерулонефрита у человека и в эксперименте;
(2) активацией лимфоцитов in vitro и in vivo при контакте с антигенами при гломерулонефрите у человека и в эксперименте;
(3) прекращением повреждения клубочков при истощении лимфоцитов;
(4) индукцией повреждения клубочков при переносе Т-клеток от больных животных к здоровым. При некоторых формах БПГН активированные Т-лимфоциты способствуют распространению воспаления, вызванного антителами к БМК.
е) Альтернативный путь активации системы комплемента. Альтернативный путь активации системы комплемента участвует в патогенезе МПГН типа II, а также может вовлекаться в патогенез некоторых пролиферативных гломерулонефритов.
ж) Повреждение эпителия. Повреждение эпителия может быть вызвано антителами к антигенам его висцерального слоя, токсинами (например, в экспериментальной модели протеинурии, вызванной введением аминонуклеозида пуромицина), некоторыми цитокинами или еще мало изученными факторами, как в случае болезни минимальных изменений и ФСГС (см. далее). Эти повреждения сопровождаются изменениями морфологии подоцитов, включая сглаживание их отростков, вакуолизацию, а также ретракцией, потерей адгезии и отслойкой подоцитов от базальной мембраны, что проявляется протеинурией.
з) Медиаторы повреждения клубочков. Какие механизмы вовлечены в повреждение клубочка при попадании в него сенсибилизированных Т-клеток и возбудителей иммунных реакций? Основными медиаторами острого и хронического воспалений являются клетки и молекулы. Рассмотрим лишь некоторые из них.
- Клетки. При определенных видах гломерулонефрита нейтрофилы и моноциты инфильтрируют клубочек, как правило, в результате активации системы комплемента, вызывающей продукцию хемотаксических агентов (в основном С5а), а также путем Fc-опосредованных адгезии и активации. Нейтрофилы выделяют протеазы, вызывающие деградацию БМК, АФК, инициирующие повреждение клеток, и метаболиты арахидоновой кислоты, снижающие СКФ.
Макрофаги, Т-лимфоциты и NK-клетки, инфильтрирующие клубочек при антитело-опосредованном и клеточно-опосредованном иммунных ответах, в случае активации выделяют множество биологически активных молекул.
При иммунном повреждении в клубочке происходит агрегация тромбоцитов. Высвобождаемые при этом эйкозаноиды и факторы роста могут привести к манифестации гломерулонефрита. Антитромбоцитарные агенты оказывают благоприятное влияние на течение гломерулонефрита как у животных, так и у человека.
Резидентные клетки клубочка, особенно мезангиальные, могут продуцировать некоторые медиаторы воспаления, в частности АФК, цитокины, хемокины, факторы роста, эйкозаноиды, оксид азота и эндотелии. При отсутствии лейкоцитарной инфильтрации эти вещества могут инициировать в клубочках воспалительную реакцию.
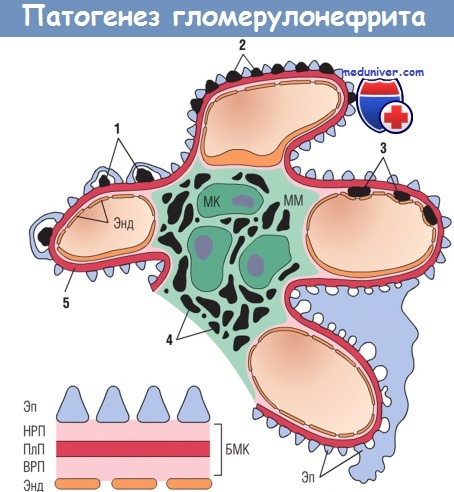
(1) субэпителиальные депозиты (при остром гломерулонефрите);
(2) эпимембранозные депозиты (при мембранозной нефропатии и нефрите Хейманна);
(3) субэндотелиальные депозиты (при волчаночном гломерулонефрите и мембранопролиферативном гломерулонефрите);
(4) мезангиальные депозиты (при нефропатии IgA);
(5) базальная мембрана.
БМК — базальная мембрана клубочка; ВРП — внутренняя рыхлая пластинка;
МК — мезангиальная клетка; ММ — мезангиальный матрикс;
НРП — наружная рыхлая пластинка; ПлП — плотная пластинка;
Энд — эндотелий; Эп — эпителий.
- Молекулы. В патогенезе гломерулярных повреждений участвуют практически все известные медиаторы воспаления.
Хемотаксические компоненты системы комплемента С5b-С9 индуцируют приток лейкоцитов (так называемое комплемент-нейрофил-зависимое повреждение), что приводит к формированию мембраноатакующих комплексов. С5b-С9 вызывает лизис клеток и стимулирует продукцию оксидантов, протеаз и других медиаторов воспаления мезангиальными клетками. Таким образом, даже при отсутствии нейтрофилов наличие С5b-С9 может привести к протеинурии, которая наблюдается при мембранозной нефропатии.
Эйкозаноиды, оксид азота, ангиотензин и эндотелии влияют на гемодинамику.
Цитокины, особенно IL-1 и TNF, продуцируемые лейкоцитами и резидентными клетками клубочка, вызывают адгезию лейкоцитов и другие эффекты.
Хемокины, например моноритарный хемоаттрактантный белок 1 и CCL5, стимулируют приток моноцитов и лейкоцитов.
Факторы роста (например, PDGF) участвуют в регуляции пролиферации мезангиальных клеток. TGF-b, фактор роста соединительной ткани и фактор роста фибробластов, по всей видимости, играют критическую роль в накоплении ВКМ и гиалинозе, что приводит к гломерулосклерозу при хронических поражениях почек. Предполагается, что VEGF поддерживает целостность эндотелия и может регулировать проницаемость капилляров.
Система коагуляции также является медиатором повреждений клубочка. При гломерулонефритах в клубочке часто содержится фибрин, который может просачиваться в пространство капсулы Боумена и стимулировать пролиферацию париетальных клеток (т.е. формирование полулуний). Отложение фибрина происходит в основном из-за стимуляции прокоагулянтной активности макрофагов. Ингибитор активатора плазминогена типа 1 усиливает тромбоз и фиброз путем ингибирования процесса разрушения фибрина и матриксных белков.
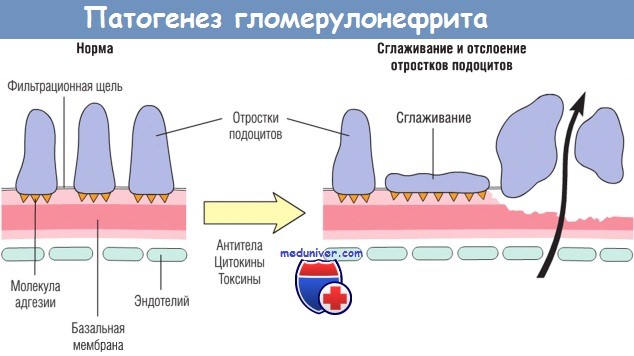
цитокинов или других повреждающих факторов приводит к сглаживанию отростков подоцитов и иногда к отслоению подоцитов от базальной мембраны.
В результате нарушается процесс фильтрации через поврежденную БМК и происходит потеря (стрелка) белка.
NK-клетки — естественные клетки-киллеры.
- Рекомендуем ознакомиться со следующей статьей "Механизм развития (патогенез) прогрессирования гломерулонефрита"
Оглавление темы "Патогенез болезней почек":- Признаки и клиника болезней почек
- Клиника гломерулонефрита (гломерулопатии)
- Морфология гломерулонефрита (гломерулопатии)
- Механизм развития (патогенез) гломерулонефрита - гломерулопатии
- Механизм развития (патогенез) прогрессирования гломерулонефрита
- Механизм развития (патогенез) острого пролиферативного гломерулонефрита
- Механизм развития (патогенез) быстропрогрессирующего гломерулонефрита (БПГН)
- Механизм развития (патогенез) нефротического синдрома
- Механизм развития (патогенез) мембранозной нефропатии
- Механизм развития (патогенез) болезни минимальных изменений

