Механизмы развития (патогенез) наследственного дефицита глюкозо-6-фосфатдегидрогеназы (G6PD)
Эритроциты чувствительны к повреждениям, вызываемым экзо- и эндогенными оксидантами. Дефицит ферментов гексозомонофосфатного пути или метаболизма глутатиона снижает способность эритроцитов защищать себя от оксидантов, что приводит к гемолизу. Наиболее важное из этих нарушений — наследственный дефицит глюкозо-6-фосфатдегидрогеназы (G6PD).
G6PD восстанавливает никотинамидадениндинуклеотидфосфат (NADP) до NADPH, окисляя глюкозо-6-фосфат. Затем NADPH выполняет роль восстанавливающего эквивалента, необходимого для превращения окисленного глутатиона в восстановленный глутатион, который создает защиту от окислительного повреждения, катализируя расщепление таких агентов, как пероксид водорода (Н2О2).
Дефицит G6PD ассоциируется с рецессивным, сцепленным с Х-хромосомой типом наследования, подвергающим мужчин наивысшему риску развития симптоматического заболевания. Известно несколько сотен генетических вариантов G6PD, однако большинство из них клинически незначимы. Лишь два варианта — G6PD и так называемый средиземноморский тип G6PD — вызывают клинически значимые гемолитические анемии.
G6PD-присутствует у 10% лиц с темным цветом кожи; средиземноморский тип G6PD преобладает на Среднем Востоке. Предполагается, что высокая частота этих вариантов G6PD обусловлена защитной функцией этого фермента от малярии, вызываемой Р. falciparum.
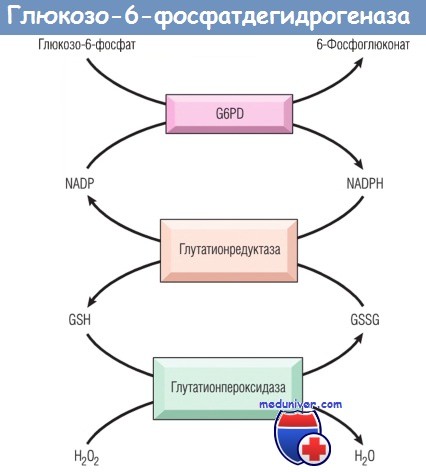
Удаление пероксида водорода (Н2О2), потенциального оксиданта, зависит от присутствия восстановленного глутатиона (GSH),
образующегося в результате действия восстановленного никотинамидадениндинуклеотидфосфата (NADPH).
Синтез NADPH зависит от активности G6PD.
GSSG — окисленный глутатион; NADP — никотинамидадениндинуклеотидфосфат.
Варианты G6PD, ассоциированные с гемолизом, характеризуются дефектами свертывания молекул белка, делая его более чувствительным к протеолитической деградации. По сравнению с наиболее часто встречающимся нормальным вариантом G6PD В период полужизни G6PD- умеренно снижен, а в случае средиземноморского типа изменение периода полужизни G6PD более значительно.
Поскольку зрелые эритроциты не синтезируют новых белков, ферментативная активность G6PD или средиземноморского типа G6PD быстро снижается до уровня, неспособного защитить эритроциты от оксидантного стресса по мере их старения. Таким образом, старые эритроциты более подвержены гемолизу по сравнению с молодыми эритроцитами.
Эпизодический гемолиз, характерный для дефицита G6PD, возникает в результате воздействия факторов, образующихся при оксидантном стрессе. Наиболее частым индуктором служат инфекции, при которых активированные лейкоциты образуют АФК. Вызвать гемолиз способны многие инфекции, особенно вирусный гепатит, пневмония и брюшной тиф. Другими индукторами являются лекарственные средства и некоторые пищевые продукты.
Лекарства-оксиданты многочисленны и включают противомалярийные средства (например, примахин и хлорохин), сульфонамиды, нитрофурантоины и др. Некоторые лекарственные средства вызывают гемолиз только у лиц со средиземноморским типом G6PD. Из пищевых продуктов наиболее часто индукторами гемолиза являются конские бобы (Vida faba), при переваривании которых образуются оксиданты.
Фавизм — эндемичное заболевание для стран Средиземноморского бассейна, Среднего Востока и районов Африки, где конские бобы употребляют в пищу. В отсутствие инфекции или известных факторов окружающей среды дефицит G6PD иногда принимает форму желтухи новорожденных или хронической гемолитической анемии легкой степени.
У лиц с дефицитом G6PD оксиданты вызывают как внутрисосудистый, так и внесосудистый гемолиз. Воздействие высоких доз оксидантов на эритроциты с дефицитом G6PD приводит к перекрестному связыванию реактивных сульфгидрильных групп цепей глобина, которые денатурируют и образуют мембраносвязанные преципитаты, известные как тельца Хайнца. Эти тельца выглядят темными включениями в эритроцитах, окрашенных кристаллвиолетом.
Тельца Хайнца могут повредить мембрану в такой степени, что происходит внутрисосудистый гемолиз. Менее серьезные повреждения мембраны приводят к снижению способности эритроцитов к деформации. Когда имеющие включения эритроциты проходят через селезеночные тяжи, макрофаги «выкусывают» тельца Хайнца. В результате повреждения мембраны клетки приобретают характерную аномальную форму (см. рис. 14.6). Менее поврежденные клетки (с утратой поверхностного участка мембраны) способны восстановить свою форму до сферической. И «надкушенные» клетки, и сфероциты задерживаются в селезеночных тяжах и быстро захватываются фагоцитами.
Острый внутрисосудистый гемолиз, проявляющийся анемией, гемоглобинемией и гемоглобинурией, обычно манифестирует у лиц с дефицитом G6PD через 2-3 сут после воздействия оксидантов. Наблюдается тенденция к более сильному гемолизу у лиц со средиземноморским типом G6PD. Поскольку гемолиз касается только более старых эритроцитов, он является самокупарующимся, т.е. прекращается, как только остаются лишь молодые эритроциты, содержащие достаточное количество G6PD (даже если продолжается воздействие вещества, индуцирующего гемолиз).
О фазе восстановления свидетельствует ретикулоцитоз. Поскольку эпизоды гемолиза, связанные с дефицитом G6PD, происходят лишь время от времени, признаки хронической гемолитической анемии (спленомегалия, холелитиаз) отсутствуют.
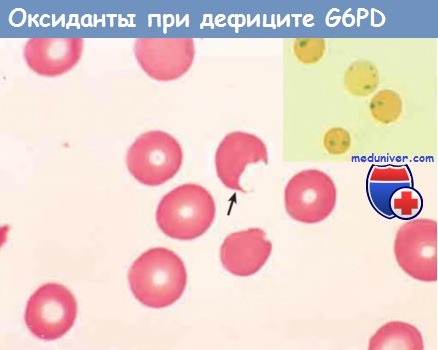
Врезка: эритроциты с преципитатами денатурированного глобина (тельца Хайнца), выявляемые с помощью суправитального окрашивания.
Поскольку макрофаги в селезенке «выкусывают» эти включения, образуются «надкушенные» клетки (стрелка).
- Вернуться в оглавление раздела "Патофизиология"
Оглавление темы "Патогенез заболеваний крови":- Механизмы развития (патогенез) застойной спленомегалии
- Механизмы развития (патогенез) инфаркта селезенки
- Строение и функции тимуса
- Механизмы развития (патогенез) нарушений развития тимуса
- Механизмы развития (патогенез) тимомы
- Классификация анемий
- Механизмы развития (патогенез) анемии при кровопотере
- Механизмы развития (патогенез) гемолитической анемии
- Механизмы развития (патогенез) наследственного сфероцитоза
- Механизмы развития (патогенез) наследственного дефицита глюкозо-6-фосфатдегидрогеназы (G6PD)

