1. Расстройство утилизации энергии. Повреждение клеточных мембран и ферментов клетки.
2. Свободнорадикальные реакции. Этапы свободнорадикального перекисного окисления липидов.
3. Антиоксидантная защита клеток. Чрезмерная активация свободнорадикальных и перекисных реакций.
4. Детергентные эффекты амфифилов. Нарушения конформации макромолекул. Перерастяжение и разрыв мембран клеток.
5. Дисбаланс ионов и воды в клетке. Проявления ионного дисбаланса в клетке. Проявления ионного дисбаланса.
6. Последствия генетических нарушений в клетке. Межклеточные информационные сигналы.
7. Причины повреждения клетки. Повреждающие факторы клетки.
8. Расстройства взаимодействия БАВ с рецепторами. Расстройства на уровне вторых посредников. Расстройства на уровне ответа на сигнал.
9. Типовые формы патологии. Дистрофии. Виды клеточных дистрофий.
10. Диспротеинозы. Зернистая дистрофия. Гиалиновая дистрофия. Гидропическая дистрофия.
Расстройство утилизации энергии. Повреждение клеточных мембран и ферментов клетки.
Нарушения энергообеспечения клеток и расстройства их жизнедеятельности могут развиваться в результате повреждения механизмов утилизации энергии, главным образом за счёт уменьшения активности АТФаз (АТФаза миозина, Na+,К+-АТФаза плазмолеммы, протонная и калиевая АТФаза, Са2+-АТФаза [Са2+-насос] и др.). Следовательно, расстройство жизнедеятельности клеток может развиваться даже в условиях нормального или повышенного содержания в клетке АТФ.
Нарушение энергообеспечения, в свою очередь, может стать одним из факторов расстройств функции мембранного аппарата клеток, их ферментных систем, процессов транспорта ионов и воды, а также механизмов регуляции клетки.
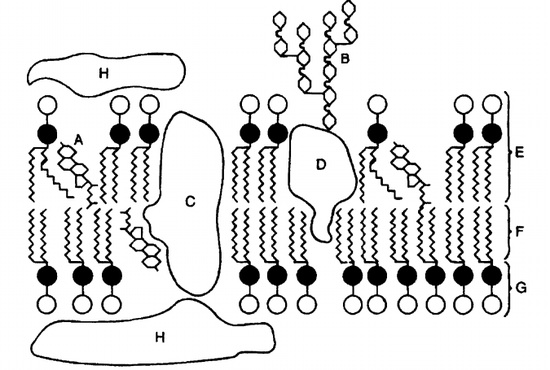
Повреждение клеточных мембран и ферментов клетки
Повреждение клеточных мембран и ферментов играет существенную роль в расстройстве жизнедеятельности клетки, а также — что особенно важно — в переходе обратимых изменений в ней в необратимые.
Согласно жидкостно-мозаичной модели, мембрана клетки — жидкая динамическая система с мозаичным расположением белков и липидов. Основу мембраны составляют молекулы фосфолипидов (липидная фаза), полярные (ионные) «головки» которых направлены к водной среде, т.е. к гидрофильным поверхностям мембраны (гидрофильная зона), а неполярные части — «хвосты» — внутрь мембраны (гидрофобная зона). В фосфолипидной среде «взвешены» белковые молекулы, часть из которых полностью погружена в мембрану и пронизывает их толщу (так называемые интегральные белки), а часть расположена поверхностно (периферические белки). Периферические белки не проникают в толщу мембраны и удерживаются на её поверхности главным образом электростатическими силами.
В плоскости мембраны белки обладают латеральной подвижностью. Интегральные белки перераспределяются в мембранах в результате взаимодействия с периферическими белками, элементами цитоскелета, молекулами в мембране соседней клетки и компонентами внеклеточного матрикса. В то же время подвижность интегральных белков в мембране ограничена вследствие их взаимодействия с периферическими белками и элементами цитоскелета, а также гидрофобного связывания с липидами. Для белков-ферментов эти обстоятельства влияют на интенсивность и характер протекания катализируемых ими реакций. Кроме того, липиды мембран обеспечивают оптимальные условия для энзиматических процессов. Например, окислительное фосфорилирование требует безводной среды, что предотвращает спонтанный гидролиз АТФ.
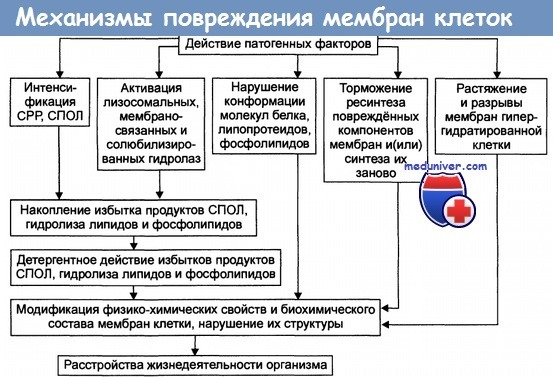
Основные механизмы повреждения клеточных мембран приведены на рисунке. Все указанные механизмы прямо или опосредованно ведут к повреждению, изменению конформации и/или кинетических свойств ферментов, многие из которых связаны с мембранами.
- Читать дале "Свободнорадикальные реакции. Этапы свободнорадикального перекисного окисления липидов."

