1. Молекулярная диагностика пороков развития. Гибридизация ДНК. Блот-гибридизация. Клонирование ДНК. ПЦР.
2. Биологическое моделирование. Принципы лечения наследственных болезней.
3. Профилактика наследственных болезней. Пренатальная диагностика наследственных болезней.
4. Преклиническая диагностика наследственных болезней. Контроль мутагенной опасности.
5. Патология клетки. Гомеостаз. Адаптация.
6. Гибель клетки. Некроз. Апоптоз. Повреждение клетки.
7. Причины повреждения клетки. Повреждающие факторы клетки.
8. Биологические факторы повреждения клетки. Природа повреждающих факторов клетки.
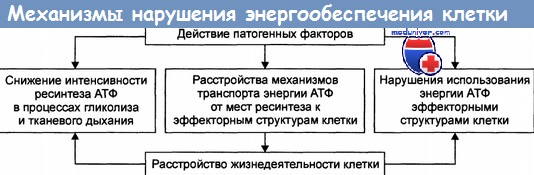
9. Эффекты повреждающих факторов. Общие механизмы повреждения клетки.
10. Нарушение энергетического обеспечения клетки. Расстройства транспорта энергии в клетке.
Нарушение энергетического обеспечения клетки. Расстройства транспорта энергии в клетке.
Энергетическое обеспечение клеток осуществляется за счёт АТФ, образующейся преимущественно в митохондриях. Из множества выполняемых митохондриями функций наиболее важны окисление в цикле Кребса, транспорт электронов, хемиосмотическое сопряжение, фосфорилирование АДФ, сопряжение окисления и фосфорилирования.
Окисление в цикле Кребса
В отличие от анаэробного гликолиза, в ходе которого из одной молекулы глюкозы образуются две молекулы пирувата, цикл Кребса требует участия кислорода. Гликолиз протекает в цитозоле, и образующийся пируват поступает с помощью его переносчика в митохондрии в обмен на ОН". Матрикс митохондрий содержит ферменты, окисляющие пируват и жирные кислоты до ацетил-КоА, и ферменты, окисляющие ацетил-КоА до С02. Конечные продукты цикла три-карбоновых кислот (С02, выходящий из клетки, и НАДН) — источник электронов, переносимых дыхательной цепью.
Транспорт электронов
Электроны перемещаются по дыхательной цепи, локализованной во внутренней мембране митохондрий и содержащей четыре крупных ферментных комплекса (преимущественно цитохромы) цепочки транспорта электронов.
Хемиосмотическое сопряжение
Сопряжение переноса электронов и синтеза АТФ обеспечивает протонный градиент. Внутренняя мембрана митохондрий непроницаема для анионов и катионов. Но при прохождении электронов по дыхательной цепи ионы Н+ откачиваются из матрикса в межмембранное пространство. Энергия электрохимического протонного градиента используется для синтеза АТФ и транспорта метаболитов и неорганических ионов в матрикс.
Фосфорилирование АДФ
Кристы митохондрий содержат АТФ-синтетазу, сопрягающую окисление в цикле Кребса и фосфорилирование АДФ до АТФ. АТФ синтезируется при обратном токе протонов в матрикс через канал в АТФ-синтезирующем комплексе.
Сопряжение окисления и фосфорилирования
В результате сопряжения этих процессов энергия, освобождаемая при окислении субстратов, хранится в макроэргических связях АТФ. Освобождение энергии, запасённой в АТФ, в дальнейшем обеспечивает выполнение многочисленных функций клеток (например, мышечное сокращение, подвижность жгутика сперматозоида, выкачивание Н+ из париетальных клеток в железах желудка для поддержания кислой среды). Эффективность окислительного фосфорилирования в митохондриях выше эффективности гликолиза в цитозоле. Из одной молекулы глюкозы в первом случае образуется 38 молекул АТФ, а во втором — только 2.
Нарушения ресинтеза АТФ
Ресинтез АТФ нарушается в результате дефицита кислорода и/или субстратов метаболизма, снижения активности ферментов тканевого дыхания и гликолиза, повреждения и разрушения митохондрий, в которых осуществляются реакции цикла Кребса и перенос электронов к молекулярному кислороду, сопряжённый с фосфорилированием АДФ.
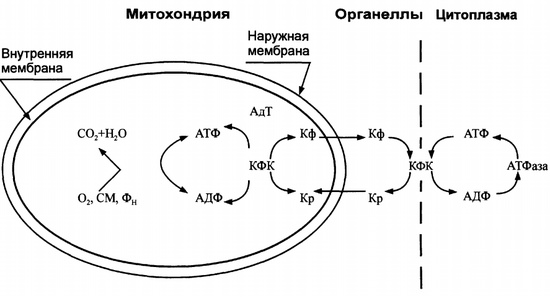
Расстройства транспорта энергии
Заключённая в макроэргических связях энергия АТФ в норме доставляется от мест ресинтеза — митохондрий и цитозоля — к эффекторным структурам (мио-фибриллам, мембранным ионным насосам и др.) с помощью АДФ-АТФ-транс-локазы (адениннуклеотидилтрансферазы) и КФК.
Адениннуклеотидилтрансфераза обеспечивает транспорт энергии макроэргической фосфатной связи АТФ из матрикса митохондрий через их внутреннюю мембрану, а КФК переносит её далее на креатин с образованием креатинфосфата, который поступает в цитозоль. КФК эффек-торных клеточных структур транспортирует фосфатную группу креатинфосфата на АДФ с образованием АТФ, который и используется в процессах жизнедеятельности клетки.
Системы транспорта энергии могут быть повреждены различными патогенными агентами, в связи с чем (даже на фоне высокого общего содержания АТФ в клетке) может развиваться дефицит АТФ в энергорасходующих структурах.
- Вернуться в оглавление раздела "Патофизиология."

