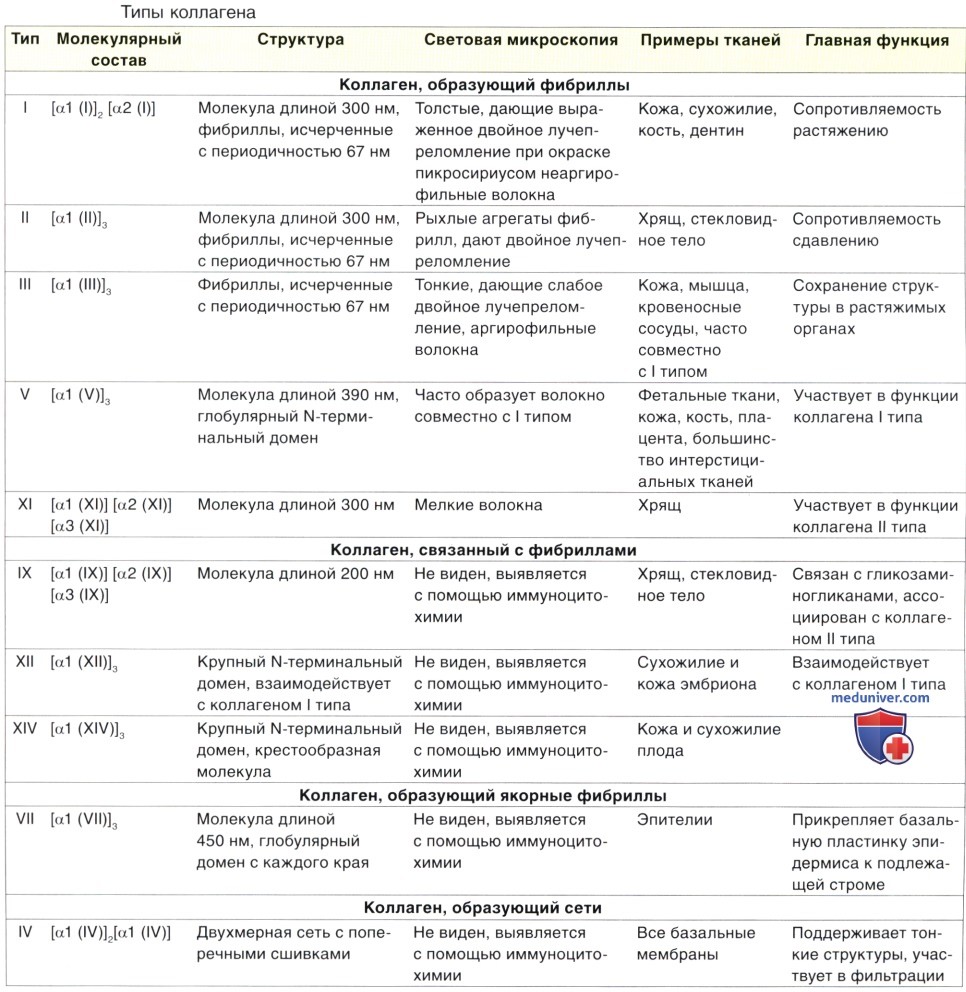
Строение, функции коллагеновых волокон. Типы
Волокна соединительной ткани образованы белками, которые полимеризуются с формированием удлиненных структур. Тремя главными типами волокон соединительной ткани являются коллагеновые, ретикулярные и эластические. Белок коллаген образует коллагеновые и ретикулярные волокна, а белок эластин — эластические волокна. Эти волокна в различных типах соединительной ткани распределены неравномерно.
В действительности имеются две системы волокон: коллагеновая система, состоящая из коллагеновых и ретикулярных волокон, и эластическая система, представленная эластическими, элауниновыми и окситалановыми волокнами. Во многих случаях специфические свойства конкретной ткани определяются преобладающим типом волокон.
Коллагены представляют собой семейство белков, которые в процессе эволюции многоклеточных организмов претерпели селекцию, направленную на выполнение ими нескольких (преимущественно структурных) функций. В ходе эволюции эти белки модифицировались под влиянием внешней среды и в связи с функциональными потребностями организма животных, приобретя различную степень жесткости, эластичности и прочности.
Общее название белков данного семейства — коллаген, причем главные представители его различных типов присутствуют в коже, кости, хряще, гладкой мышечной ткани и базальной пластинке.
Коллаген — самый распространенный белок человеческого тела, на него приходится 30% его сухого веса. Коллагены позвоночных образуют семейство, состоящее более чем из 25 членов, которые вырабатываются несколькими типами клеток и различаются своим молекулярным составом, морфологическими характеристиками, распределением, функциями и характером изменений в патологических состояниях.
На основании структуры и функций их можно разделить на следующие группы:
• коллагены, образующие длинные фибриллы;
• коллагены, связанные с фибриллами;
• коллагены, образующие сети;
• коллагены, образующие якорные фибриллы.
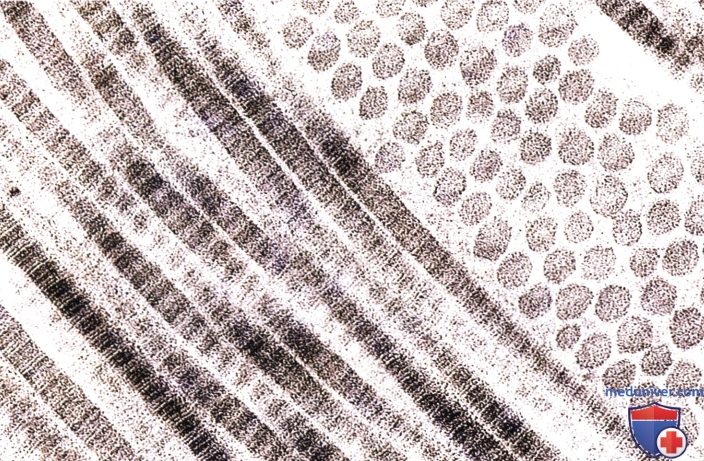
Каждая фибрилла состоит из правильно чередующихся темных и светлых полос, которые далее разделены поперечными линиями.
Фибриллы полностью окружены основным веществом. Электронная микрофотография, х100 000.
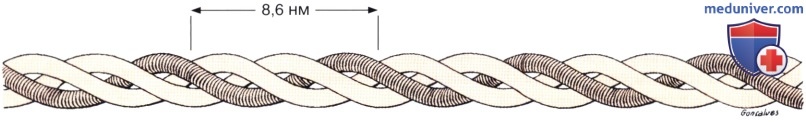
Каждый полный виток спирали занимает 8,6 нм. Длина каждой молекулы тропоколлагена составляет 280 нм, а ее ширина — 1,5 нм.
Коллагены, образующие длинные фибриллы. Молекулы коллагенов, образующих длинные фибриллы, объединяются с формированием фибрилл, которые отчетливо выявляются под электронным микроскопом. К ним относятся коллагены I, II, III, V и XI типов. Коллаген I типа содержится в наибольшем количестве и широко распространен в организме. Он встречается в тканях в виде структур, которые классически описываются как коллагеновые волокна и образуют кости, дентин, сухожилия, капсулы органов и дерму.
Коллагены, связанные с фибриллами. Коллагены, связанные с фибриллами, представляют собой короткие структуры, которые связывают коллагеновые фибриллы друг с другом и с другими компонентами межклеточного вещества. К ним относятся коллагены IX, XII и XIV типов.
Коллагены, образующие сети. Молекулы коллагена, образующего сети, или коллагена IV типа, собираются в сеть, которая является структурным компонентом базальной пластинки.
Коллагены, образующие якорные фибриллы. Якорный коллаген, или коллаген VII типа, содержится в якорных фибриллах, которые прикрепляют коллагеновые волокна к базальной пластинке.
Синтез коллагена, как полагали первоначально, является результатом деятельности ограниченного числа клеток — фибробластов, хондробластов, остеобластов и одонтобластов, однако в настоящее время показано, что он широко распространен, причем этот белок вырабатывают клетки многих типов. Главными аминокислотами, входящими в состав коллагена, являются глицин (33,5%), пролин (12%) и гидроксипролин (10%).
Коллаген содержит две аминокислоты, которые характерны для этого белка, — гидроксипролин и гидроксилизин.
Белковой единицей, которая полимеризуется с формированием коллагеновых фибрилл, является удлиненная молекула — тропоколлаген, которая достигает 280 нм в длину и 1,5 нм в ширину. Тропоколлаген состоит из трех субъединиц — полипептидных цепей, скрученных в тройную спираль. Различия в типах коллагена обусловлены неодинаковой химической структурой этих полипептидных цепей.
В коллагенах I, II и III типовтропоколлагеновые молекулы объединяются в микрофибриллярные субъединицы, которые упакованы вместе, образуя фибриллы. В агрегации и упаковке этих элементов важную роль играют водородные связи и гидрофобные взаимодействия. Наследующем этапе данная структура усиливается благодаря формированию ковалентных поперечных связей, причем этот процесс катализируется благодаря активности фермента лизилоксидазы.
Коллагеновые фибриллы представляют собой тонкие, удлиненные структуры вариабельного диаметра (колеблется от 20 до 90 нм), которые могут достигать нескольких микрометров в длину; они обладают поперечной исчерченностью с характерной периодичностью в 64—67 нм. Поперечная исчерченность коллагеновых фибрилл определяется перекрывающимся расположением молекул тропоколлагена.
Темные полосы задерживают больше содержащего свинец красителя, который используется в электронно-микроскопических исследованиях, поскольку их более многочисленные свободные химические группы интенсивнее реагируют с раствором свинца, чем в светлых полосах. В коллагенах I и III типов эти фибриллы связываются друг с другом, образуя волокна. В коллагене I типа волокна могут объединяться, формируя пучки. Коллаген II типа (присутствующий в хряще) встречается в виде фибрилл, но не формирует волокон или их пучков.
Коллаген IV типа, имеющийся во всех базальных мембранах, не образует ни фибрилл, ни волокон. Вследствие своей молекулярной конфигурации коллаген IV типа организован в виде густой сетки.
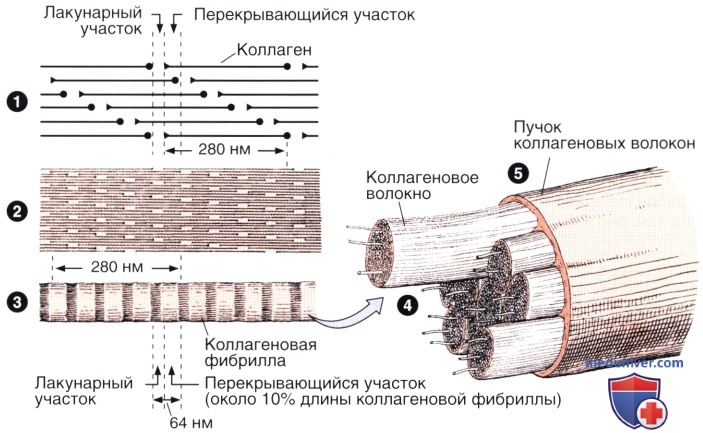
Стержневидные тропоколлагеновые субъединицы длиной 280 нм располагаются ступенчато с частичным перекрытием (1).
Такое расположение определяет образование чередующихся лакунарных и перекрывающихся участков (2), что обусловливает поперечную исчерченность, характерную для коллагеновых фибрилл и периодичное чередование темных и светлых полос с шагом 64 нм, видное при изучении фибриллы под электронным микроскопом (3).
В результате агрегации фибрилл формируются волокна (4), которые объединяются, образуя пучки (5), обычно называемые коллагеновыми волокнами. Коллаген III типа, как правило, не образует пучков.
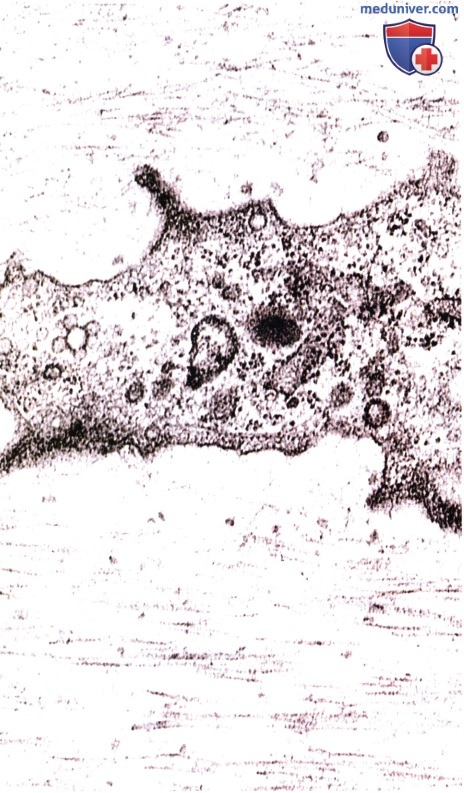
Поперечная исчерченность фибрилл едва заметна вследствие взаимодействия коллагена с хондроитинсульфатом. В центре — часть хондроцита.
Сравните вид этих фибрилл с аналогичными структурами в волокнистом хряще. Электронная микрофотография.
- Читать далее "Биосинтез коллагена I типа. Нарушения синтеза"
Оглавление темы "Гистология соединительной ткани":- Опухоли из эпителиальных клеток: карцинома - рак
- Соединительная ткань: строение - гистология
- Строение, функции фибробластов
- Строение, функции макрофагов, мононуклеарных фагоцитов
- Строение, функции тучных клеток
- Строение, функции плазматических клеток - плазмоцитов
- Строение, функции лейкоцитов
- Строение, функции коллагеновых волокон. Типы
- Биосинтез коллагена I типа. Нарушения синтеза
- Коллагеновые волокна образованные коллагеном I типа: строение, гистология

