Генотерапия наследственных заболеваний - возможности, перспективы
До сих пор диагноз наследственного заболевания воспринимается как серьезный приговор, так как существует предвзятое отношение к возможностям терапии наследственной патологии. Однако еще в 30-е годы С.Н.Давиденков указал на ошибочность точки зрения о неизлечимости наследственных болезней. Он исходил из признания роли факторов внешней среды в проявлении наследственной патологии. В настоящее время, несмотря науспехи генетики и прогресс теоретической и клинической медицины, успешно лечатся очень немногие наследственные болезни - методом пересадки генов или тканей. В большинстве же случаев моделируется нормальный фенотип, но генные мутации сохраняются.
Общие подходы к лечению наследственных заболеваний остаются теми же, что и подходы к лечению болезней другого происхождения: принцип индивидуализации - лечить не болезнь, а больного. Может быть при наследственной патологии принцип индивидуализированного лечения должен быть особенно выдержан, так как гетерогенность наследственных болезней еще далеко не расшифрована, а следовательно, под видом одной и той же клинической картины болезни могут протекать разные наследственные болезни с разным патогенезом. Естественно, что окружающая среда модифицирует проявления мутации и поэтому не могут быть и однотипными подходы к коррекции болезни у разных лиц.
Можно выделить 3 подхода к лечению наследственных болезней и болезней с наследственным предрасположением:
• этиологический,
• патогенетический,
• симптоматический.
Этиологическими факторами большинства моногенных болезней являются мутации генов. В связи с этим радикальным способом лечения наследственных моногенных болезней, обусловленных мутациями единственного гена, очевидно, является генная терапия. В упрощенном виде - это своеобразная хирургическая операция по замене дефектного гена на нормальный, что должно привести к излечению от наследственного заболевания. Однако для реализации подобной операции необходимо преодолеть множество препятствий. Во-первых, необходимо знать точную локализацию генных дефектов, вызывающих наследственное заболевание на определенной хромосоме, во-вторых, установить характер и тип точковых мутаций, лежащих в основе моногенного заболевания.
Помимо этого, нужно синтезировать вводимый ген, осуществить его клонирование, создать банк данных (клонотеки), осуществить встраивание гена в хромосому и, наконец, добиться его функционирования, то есть решить многие методические трудности, возникающие при генной терапии наследственных моногенных болезней.
За последние годы внесены значительные коррективы в понятие «генотерапия». Если первоначально генная терапия рассматривалась как возможность исправления дефекта в гене, то после многочисленных экспериментов, проведенных после 80-х годов, стало очевидным, что значительно проще исправлять не сам дефект в гене, то есть заменять весь мутантный ген на нормальный, а вести коррекцию путем введения в организм больного полноценно работающий ген, обычно его комплементарную ДНК (кДНК). Таким образом, оказалось достаточным введения в организм больного генной конструкции, которая способна нормально работать (экспрессироваться) и восполнять недостающий биохимический продукт.
При этом оказалось, что введение генных конструкций в половые клетки преждевременно, так как исследователи пока не в состоянии прогнозировать возможные негативные последствия такого вмешательства. Несмотря на успехи генно-инженерной технологии, генная терапия осуществляется в современных условиях исключительно на соматических тканях и клетках, в которых в норме происходит экспрессия дефектного гена, использование ее на уровне половых клеток малореально и проблематично. Введение генов с лечебной целью используется в настоящее время не только для лечения моногенных болезней, но и других заболеваний (злокачественные опухоли, СПИД, вирусные инфекции и др.).
Поэтому генную терапию в широком смысле можно определить как способ лечения наследственных заболеваний путем введения генов в клетки больных с целью направленного изменения генных дефектов или придания клеткам физиологических функций (Culver K.W.) Таким образом, генотерапия - это лечение генных болезней с помощью введения в организм пациента (в клетки или ткани) молекул ДНК, способных продуцировать дефицитный первичный продукт гена.
В последние годы появились реальные предпосылки для практического применения генной терапии и получены первые результаты ее использования. Прошло немного времени с тех пор, как стало известно, - начиная с 1960-1965 годов, - что клетки животных и человека способны поглощать экзогенно введенную ДНК, встраивать ее в свой геном и активно экспрессировать отсутствующие белки или ферменты. Но при этом возникли значительные трудности с доставкой генов в соответствующие локусы. Первая попытка использования генной терапии была предпринята М.Клайном в 1983 году у больных с бета-талассемией, когда было осуществлено введение нормального бета-глобинового гена.
Впервые генотерапия у детей была использована 14 сентября 1990 г. у 4-летней девочки из г.Бетезда (США) для лечения тяжелой иммунологической недостаточности, которая была связана с мутацией гена аденозиндезаминидазы (АДА). Были взяты лимфоциты больной девочки, в них введены нормальные гены АДА с помощью ретровирусного вектора и затем вновь пересажены в ее организм. Был получен положительный лечебный эффект, восстановление активности этого энзима, и достигнутый результат сохранялся в течение нескольких месяцев. Больная после подобной генотерапии смогла вести нормальный образ жизни, у нее сократилось число интеркуррентных инфекций. Процедура повторялась каждые 3-6 месяцев. Девочка продолжает жить до настоящего времени.
Успех первых положительных клинических испытаний генной терапии привел к быстрому развитию новых генных технологий для лечения других моногенных заболеваний. Так, если к 1994 году на стадии клинических испытаний находилось пять моногенных болезней (фенилкетонурия, болезнь Гоше, муковисцидоз, семейная гиперхолестеринемия, иммунодефицитное состояние, связанное с дефицитом аденозиндезаминидазы)(СиК/ег K.W.,1994), то к середине 2003 года уже существует 636 протоколов клинических испытаний или экспериментальных разработок ген-но-терапевтических способов коррекции различных заболеваний (J.Gene Medicine Therapy ClinicalTrials). Большая часть протоколов приходится на онкологические заболевания (60 %), незначительная часть - на моногенные болезни (12 % протоколов), а остальные протоколы посвящены испытанию генно-инженерных способов коррекции сердечно-сосудистых заболеваний, созданию вакцин, лечению СПИДа, туберкулеза и других заболеваний. Расходы Национального института здравоохранения США на исследования в области генотерапии возросли с 349 млн долларов в 2001 году до 427 млн долларов в 2003 г. (Natinal Institute of Health Humane Gene Transfer Database).
Ряд моногенных заболеваний, по которым проводятся клинические испытания или экспериментальные разработки, приведены в таблице.
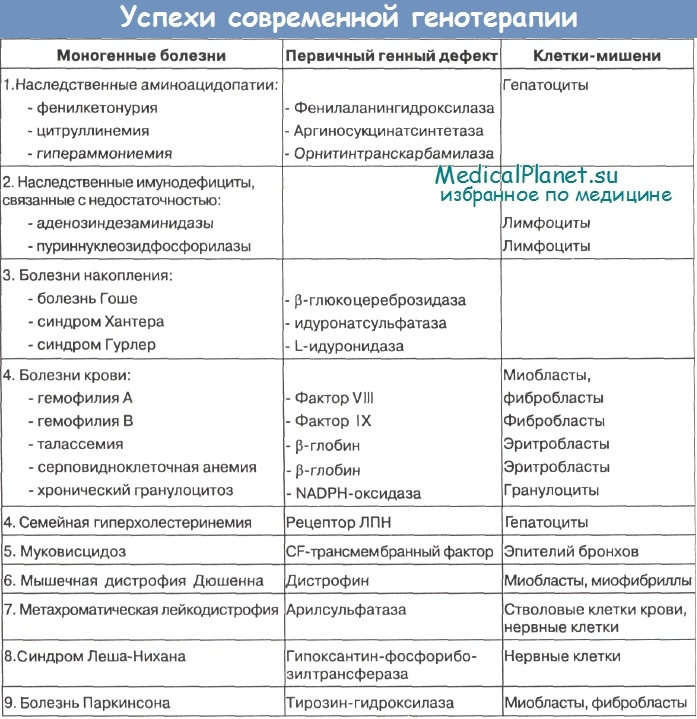
Как известно, первые программы по генной терапии были связаны, главным образом, с модификацией гемопоэтических клеток. Это и понятно, так как клетки крови (лимфоциты, макрофаги, стволовые клетки) наиболее доступны для различных генных манипуляций. Однако реципиентами могут быть и другие клетки - фибробласты, миобласты, миофибриллы. Они могут быть использованы для генной коррекции тех болезней, первичные продукты генов которых могут поступать в сыворотку крови или диффундировать в соседние клетки. Особенно перспективны для генной терапии скелетные мышцы, так как в них отсутствует активность эндонуклеаз, что позволяет переносить гены путем прямой инъекции экзогенной ДНК.
Экспрессия ДНК в миофибриллах или миобластах дает возможность накоплению белковых продуктов в крови и тем самым оказывать положительный лечебный эффект.
Однако пренебрежение рекомендациями контролирующих организаций при переходе от экспериментальных разработок к испытаниям на людях привели к ряду трагических результатов. Так, в Институте Генной Терапии Пенсильванского университета (США) в результате введения рекомбинантного аденовирусного вектора 18-летнему больному с наследственным дефицитом орнитинтранскарбамилазы на 4-й день после генотерапии наступила смерть в результате развития печеночной и почечной недостаточности. Приводятся данные о развитии у ряда больных после генной терапии Т-клеточной лейкемии. Таким образом, при проведении клинических испытаний на людях необходимы четкие разработки, организация и прогнозирование последствий. В целом, генная терапия имеет в применяемом объеме низкий процент осложнений.
Широкое распространение генной терапии в настоящее время сдерживается, главным образом, двумя обстоятельствами - чрезвычайно высокой стоимостью проведения всех фаз испытаний и недостаточной эффективностью доставки генных конструкций.
Проблема эффективной доставки генетического материала к клеткам-мишеням - одна из ключевых в генной терапии.
В настоящее время разрабатываются или испытываются многие системы доставки генных конструкций в ткани организма с целью получения правильной дозы белкового продукта, обладающего терапевтическим эффектом.
Можно выделить следующие способы введения генетического материала в клетки:
1) биологические,
2) физико-химические,
3) микротехнологические,
4) биохимические.
В большинстве случаев для этих целей используются генетически модифицированные вирусы или вирусные векторы различных типов: ретровирусы, аденовирусы, лентивирусы, аденоассоциированные вирусы, вирусы герпеса простого и др. Использование вирусов имеет свои особенности. Так, ретровирусы, главным образом, мышиные, «нагруженные» необходимыми фрагментами ДНК (генами, подлежащими встраиванию в геном больного хозяина), могут инфицировать любую клетку. При этом вирусный геном интегрируется в геном клетки хозяина и передается при делении дочерним клеткам. Однако с помощью ретровирусных векторов достижение эффекта невозможно, если ген вводится в неделящиеся клетки (нейроны) или клетки, отличающиеся малой митотической активностью (эпителий дыхательных путей).
В связи с этим были испытаны аденовирусы. Их преимуществом является то, что они проникают в неделящиеся или слабо делящиеся клетки (нервной системы, дыхательных путей), однако фрагменты ДНК вирусного генома не встраиваются в геном хозяина, хотя и проявляют генную активность. Таким образом, внеядерное расположение (эписомальная локализация) генома аденовирусов не позволяет передать генный материал дочерним клеткам.
Предпринимаются попытки введения аденовирусных векторов, экспрес-сирующих цитозиновую дезаминидазу, при этом более 90 % вируса оказывается в печени. Векторы аденовирусов используются в генной терапии рака молочной железы, яичника для доставки кистозно-фиброзного трансмембранного регулятора при муковисцидозе.
В качестве векторов используют также вирус герпеса простого. Вирус получается методами генной инженерии. Реплицируемыи вектор вируса герпеса простого способен инфицировать окружающие опухоли клетки и лизировать их. При этом создается вирус таким образом, чтобы он имел множественные мутации, исключающие возврат к дикому генотипу (Forbes S.J. et. al.).
Преимуществом этого класса вирусов является то, что гены, встроенные в геном вирусов герпеса простого, легко проникают в ядра как делящихся, так и неделящихся клеток (нейроны, печеночные клетки).
Предпринимаются попытки использования для этих целей парвовирусов.
Во всех случаях при использовании вирусов в качестве векторов генов вирусные частицы подвергаются специальной генно-инженерной обработке (многолокусное мутирование), чтобы они утратили свои вирулентные свойства (утрата способности к размножению вирусной ДНК) и не могли служить источником распространения тяжелой вирусной патологии.
Предпринимаются попытки использовать печеночные клетки для переноса генов, однако митотическая неактивность гепатоцитов препятствует интегративной передаче гена. Для повышения митотической активности печени предложены различные методы индукции репликации клеток печени in vivo, в частности , использование физиологического гормона - трийодотиронина для стимуляции репликации гепатоцитов и др. Эта процедура может использоваться до введения ретровирусного вектора. После обработки ген переносится с помощью ретровирусов.
Весьма перспективны в качестве клеток для трансдукции (переноса) генов могут служить лимфоциты, которые легко доступны, хорошо растут в культуре клеток, а также клетки костного мозга или другие клетки. Получены обнадеживающие результаты по генной терапии гемофилии В (наследственный недостаток IX фактора свертывания крови). Исследования показали, что несмотря на то, что IX фактор продуцируется гепатоцитами, введение гена этого фактора в миоциты ( мышечные клетки) и последующая реплантация миоцитов больному приводило к синтезу недостающего IX фактора свертывания крови, то есть наступала коррекция генного дефекта.
Получены положительные результаты применения векторов для введения гена бета-глобина в стволовые клетки костного мозга. На протяжении 18 месяцев клетки сохраняли способность к синтезу бета-цепи глобина.
Наряду с биологическими, применяются физико-химические методы введения экзогенной ДНК в клетки-хозяина. Для таких целей используются конъюгаты ДНК с трансферрином или асиалогликопротеином, для которых на многих клетках имеются рецепторы (лиганд - рецепторный принцип). После связывания с рецептором конъюгаты ДНК поглощаются клеткой, хотя вероятнось встраивания введенной ДНК в геном хозяина и невелика, тем не менее ген может временно выполнять свои функции.
В качестве средств доставки генов используются катионные липосомы (в основном, в генной терапии опухолей), содержащие негистоновые белки хроматина. Липосомы могут служить своеобразными переносчиками белков.
Разработаны способы эффективной доставки генов в органы и ткани для лечения классических наследственных заболеваний и дефектов (муковисцидоз, гемофилия) и ряда полигенных заболеваний (рак, артрит, болезнь Альцгеймера, болезнь Паркинсона (ген, кодирующий нейротрофный фактор глиальных клеток, защищал допаминэргические нейроны от дегенерации), СПИД и др. Находятся в стадии экспериментальных разработок методы генной терапии эмфиземы легких, фенилкетонурии, респираторного дистресс-синдрома, хронического грануломатоза, метахроматической лейкодистрофии, синдрома Леша-Нихана и др.
Используются генно-терапевтические методы лечения лейкозов, когда введенный с помощью ретровирусного вектора ген тимидинкиназы вируса герпеса простого трансформирует одноядерные периферические клетки и делает их уязвимыми к ганцикловиру (создание метода «переключателя»).
Разрабатываются неиммуногенные векторы (не содержащие гликопротеинов), пригодные для генной терапии.
Применяются различные физические способы доставки генного материала - метод электропорации, баллистической трансфекции, безыгольное введение (needle-free injection), метод микроинъекций плазмидной ДНК. Приницп метода баллистичееской трансфекции заключается в том, что золотые микрочастицы с осажденной на них ДНК вводятся в клетки под действием сжатого газа при выстреле из специального устройства («генное ружье»). При этом микрочастицы, пробивая клеточную мембрану, доставляют экзогенную ДНК в цитоплазму клетки. Метод электропорации основан на локальном изменении электропотенциала клеточной мембраны и возникновения после нескольких электрических разрядов пор, через которые повышается проникновение ДНК в клетку. Этот метод часто используется для трансфекции мышечных клеток и опухолей. При безыгольном способе введения плазмидная ДНК, осажденная на микрочастицах золота, вводится в клетку под высоким давлением потока физиологического раствора. Этот подход чаще применяется для трансфекции клеток кожи и мышц.

В перспективе методы генной терапии постоянно совершенствуются и будут находить все более широкое применение в практике лечения наследственных болезней. В ряде случаев они могут оказаться единственным способом коррекции генных дефектов.
Методы генной терапии в основном используются при лечении тяжелых заболеваний -поздних стадий рака, меланом, тяжелых поражений иммунной системы и др.
Кандидатами для генной терапии или заболеваниями, при которых будет продолжаться разработка генно-инженерных методов коррекции дефектов, на ближайшие годы планируются следующие заболевания:
• семейная гиперхолестеринемия - заболевание, которое рано приводит к развитию у молодых людей инфаркта миокарда и тяжелого прогрессирующего атеросклероза. Оно обусловлено отсутствием на мембранах клеток рецепторов для липопротеинов низкой плотности и сопровождается высоким уровнем холестерина в крови. Геном-кандидатом является ген рецептора липопротеинов низкой плотности, а клетками-мишенями - гепатоциты. Поскольку на мембранах покоящихся печеночных клеток отсутствуют рецепторы, прибегают вначале к частичной гепатоэктомии. С помощью ретровирусов ген рецептора низкой плотности вводится в печеночные клетки, после чего клетки печени инъецируются в полую вену. Это приводит к отчетливому (на 30-45 %) снижению показателей холестерина в крови. Сложность технологии препятствует пока ее широкому распространению в практике;
• болезнь Гоше (сфинголипидоз), при которой кандидатом для генотерапии служит ген бета-глюкоцереброзидазы, а клетками-мишенями - макрофаги и стволовые клетки;
• наследственные формы низкорослости, связанные с дефицитом гормона роста. Ген гормона роста удалось ввести в миоциты, которые начинали продуцировать гормон роста;
• муковисцидоз(кистофиброз) -тяжелое заболевание, связанное с поражением дыхательных путей и кишечника, и нередко заканчивающееся летально. В качестве векторов для введения гена муковисцидоза чаще всего используются аденовирусы а клеток-мишеней — эпителий бронхов;
• различные формы рака. Разработки ведутся по различным направлениям. Одно из направлений генной терапии рака состоит в том, чтобы с помощью генно-инженерных методов ввести в опухолевые клетки гены (например, ген интерферона), экспрессирующие чужеродные для реципиента белки. Иммунная система будет распознавать их как антигены и уничтожать. Другое направление предусматривает разработку технологии повышения эффективности противовирусных препаратов, используемых в лечении раковых заболеваний (например, при введении генатимидин-киназы вируса герпеса в опухолевые клетки повышается лечебный эффект ганцикловира). Открытие в последние годы многих онкогенов, локализованных на разных хромосомах, позволило интенсифицировать работы по введению в опухолевые клетки антионкогенов (генов-супрессоров опухолевого роста). Спектр генно-инженерных методов терапии рака продолжает расширяться и совершенствоваться
Весьма важной проблемой, которую приходится решать исследователям заключается в том, чтобы клетки-мишени, в которые вводятся фрагменты ДНК или гены, были способны к митотическому делению (стволовые клетки костного мозга, печени, опухолевые клетки и др.).
В России исследования по разработке физических и биологических векторов доставки генов в клетки млекопитающих проводятся в Институте молекулярной биологии им. В.А. Энгельгардта РАН (г. Москва), химических - в НИИ биомедицинской химии РАМН (г. Москва), генных конструкций для генотерапии атеросклероза - в НИИ экспериментальной медицины РАМН (г. Санкт-Петербург). Исследования по генной терапии миодистрофии Дюшенна и разработки новых невирусных (пептидных) носителей генных конструкций проводятся в Институте акушерства и гинекологии им. Д.О. Отта РАМН совместно с Институтом высокомолекулярных соединений РАН (г. Санкт-Петербург).
Кроме преодоления технических трудностей, внедрение генной терапии в широкую практику потребует разработки превентивных мер, направленных на обеспечение безопасности клинических испытаний на людях - этических, социальных, юридических.
- Рекомендуем далее ознакомиться со статьей "Этические и социальные проблемы генной терапии"
Оглавление темы "Лечение наследственных и врожденных заболеваний":- Современные методы денситометрии костной ткани
- Методы диагностики хромосомных болезней у детей
- Генотерапия наследственных заболеваний - возможности, перспективы
- Этические и социальные проблемы генной терапии
- Методы патогенетической терапии наследственных заболеваний
- Методы симптоматической терапии наследственных заболеваний
- Эмбриональная хирургия - возможности, перспективы
- Актуальность проблемы врожденных и наследственных заболеваний у детей
- История диагностики врожденных и наследственных заболеваний у детей
- Проблемы лечения врожденных и наследственных заболеваний у детей

