Методы диагностики хромосомных болезней у детей
Хромосомные болезни редко имеют четко очерченный симптомокомплекс. Исключением из этого правила является, пожалуй, синдром Дауна. В связи с этим достоверная диагностика хромосомных болезней возможна лишь после проведения цитогенетического анализа.
Таким образом, для подтверждения этиологической роли хромосомных аномалий в развитии патологического состояния используется цитогенетический метод. Следует отметить, что цитогенетический метод применяется не только для диагностики хромосомных болезней, но и широко используется для других целей - выявления феномена ломкости хромосом (при болезни Блюма, анемии Фанкони, синдроме Луи-Барра и др.); диагностики онкологичесикх заболеваний; картирования хромосом и др. Поэтому цитогенетик должен быть высококвалифицированным специалистом, который хорошо знает морфологию и строение хромосом.
Материалом для исследования хромосом часто служит периферическая кровь (3-5 мл), из которой выделяются лимфоциты. Для стимуляции митозов в этих клетках применяется фитогемагглютенин (ФГА). Клетки крови культивируют при 37 °С в течение 2-3 суток, а затем в присутствии колхицина или колцемида и гипотонического раствора готовят цитологические препараты. Для равномерного окрашивания хромосом чаще всего используется краситель Романовского-Гимзы, который дает интенсивное гомогенное окрашивание.
Хромосомный анализ включает несколько этапов: визуальную оценку препаратов; зарисовки хромосом; применение фотосъемки и раскладки кариотипа.
Линейная исчерченность хромосом выявляется при воздействии на них некоторых солевых растворов с определенным рН и температурными режимами и последующей окраски флюоресцирующими (Q-окраска) или основными красителями типа раствора Гимзы (G- и R-окраска). Применяются и другие методы окраски тех или иных районов хромосом.
Число и форма хромосом каждого биологического вида является постоянными величинами, хотя и внутри вида существуют межиндивидуальные различия по отдельным хромосомам (полиморфизм хромосом). Поэтому характеристика количества и структуры хромосом (кариотип) имеют важнейшее значение для диагностики хромосомных аномалий (аномалии кариотипа).
Такой метод диагностики хромосомных болезней называется традиционным методом цитогенетического анализа. Он включает культивирование лимфоцитов периферической крови больного, фиксирование клеток на предметном стекле в соответствующей стадии митотического цикла (метафаза, профаза) с целью получения хромосомных препаратов и последующего анализа хромосом под микроскопом. Этот классический тип диагностики позволял судить о кариотипе - числе и структуре хромосом человека.
Однако при таком подходе оставался недифференцированным ряд сложных случаев хромосомной патологии, таких как добавочная маркерная хромосома, сложные случаи хромосомного мозаицизма (в организме больного имеется несколько клонов клеток- нормальных и аномальных). Благодаря достижениям молекулярной генетики последних лет были разработаны принципиально новые методы диагностики хромосомных болезней с помощью генно-инженерных методов, основанных на технологии получения рекомбинантных молекул ДНК и использования их в виде ДНК-проб для диагностики наследственныхдефектов.
В настоящее время все шире начинают использоваться новые методы молекулярной цитогенетики, такие, как метод рекомбинантной ДНК. Рекомбинантными ДНК называют молекулы ДНК, полученные вне живой клетки (в пробирке) вследствие встраивания природной или чужеродной ДНК в вектор-бактериальную плазмиду или геном вируса. Этот метод позволяет определить пол плода без цитогенетического анализа кариотипа. С этой целью используют особый тип клонированных фрагментов ДНК человека (хромоспецифичные пробы ДНК), которые специфичны толькодля определенных пар хромосом, например, половых.
Этот метод молекулярного анализа обладает точностью и занимает малые сроки - 3-4 дня - вместо обычных 12-14 дней при применении способа культивирования клеток.
Идентификация хромосомной патологии на основе использования хромосомоспецифичных проб ДНК позволяет определить особенности хромосомного набора без прямого цитогенетического анализа с применением блот-гибридизации или гибридизации in situ.
Метод гибридизации in situ модифицирован и разработан в отделе генетики Научного центра психического здоровья РАМН (проф. Ю.Б.Юров) и лаборатории молекулярной цитогенетики Московского НИИ педиатрии и детской хирургии МЗ РФ (проф.С.Г.Ворсанова).
Схема проведения молекулярно-цитогенетической диагностики (по С.Г. Ворсановой и соавт.) представлена на рисунке.
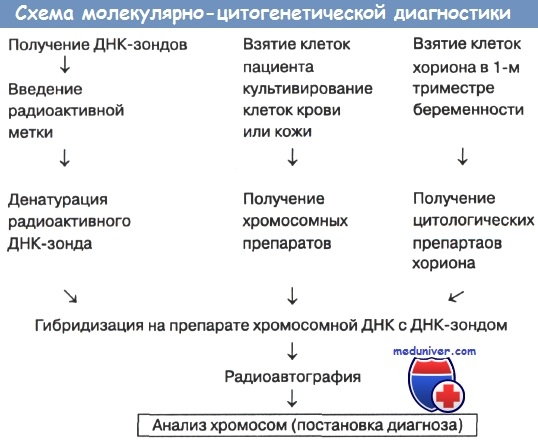
Суть методики: вначале ДНК-пробу метят тритием (3Н ). Затем пробу денатурируют прогреванием в течение 5 минут при 100° С в 20 мкл гибридизационной смеси, содержащей 2XSSC, 50 % формамида, 10 % декстрансульфата - 500 и 1-3x105 имп/мин. радиоактивной ДНК. Хромосомную ДНК на предметном стекле также денатурируют в растворе 0,07 М NaOH в течение 30 секунд с последующим промыванием препаратов в 70° С (2 раза) и 96°С(2 раза) этаноле в течение 5 минут. Гибридизацию проводят за 18 часов при 37°С, после чего следует промывание препаратов в 2-х сменах 2XSSC, 50 % формамида при 39°С в течение 5 минут; 2-х сменах 2XSSC при комнатной температуре; 2-х сменах 70°С и 96°С этанола в течение 5 минут.
Высушивают препараты на воздухе с последующим покрытием эмульсией типа М. Экспозиция препаратов под эмульсией в среднем 6 дней (от 2 до 12 дней). После этого хромосомные препараты проявляют в амидовом проявителе и окрашивают 30 % раствором красителя Райта в 0,02М фосфатном буфере при рН=6,8 с контрастированием рисунка Q-сегментации хромосом по методу Чандлера и Юниса. Анализируют радиоавтографы и фотографируют на любом оптическом микроскопе с объективом 100/1,32 при общем увеличении х1125.
При этом используются хромоспецифичные ДНК-пробы практически на все хромосомы человека (точнее на участки их околоцентромерного гетерохроматина).
Данные пробы применяются с целью:
1) анализа происхождения добавочных маркерных или минихромосом (выявление генетического состава);
2) определения сложного хромосомного мозаицизма, когда у больного имеется небольшой процент аномальных клеток;
3) идентификации хромосом, вовлеченных в сложные хромосомные нарушения;
4) уточнения точек разрыва аномальных хромосом.
Эти методы используются при диагностике синдромов Клайнфельтера (ка-риотип полной формы 47, XXY), Шерешевского-Тернера (45,Х), дисомии Y (47, XYY), трисомии X (47, XXX).
В использовании молекулярно-цитогенетической диагностики могут нуждаться до 30 % случаев хромосомной патологии (С.Г. Ворсанова и соавт.).
- Рекомендуем далее ознакомиться со статьей "Генотерапия наследственных заболеваний - возможности, перспективы"
Оглавление темы "Лечение наследственных и врожденных заболеваний":- Современные методы денситометрии костной ткани
- Методы диагностики хромосомных болезней у детей
- Генотерапия наследственных заболеваний - возможности, перспективы
- Этические и социальные проблемы генной терапии
- Методы патогенетической терапии наследственных заболеваний
- Методы симптоматической терапии наследственных заболеваний
- Эмбриональная хирургия - возможности, перспективы
- Актуальность проблемы врожденных и наследственных заболеваний у детей
- История диагностики врожденных и наследственных заболеваний у детей
- Проблемы лечения врожденных и наследственных заболеваний у детей

