Молекулярно-генетические методы диагностики наследственных заболеваний.
Наиболее адекватные методы, обеспечивающие точную диагностику моногенных заболеваний, основаны на исследовании ДНК в районе определенных генов. Несмотря на то, что молекулярно-генетические методы, как правило, весьма сложны, трудоемки и дорогостоящи, данные, полученные в процессе ДНК-диагностики намного точнее и информативнее данных других анализов. Известно, что ДНК остается неизменной на протяжении всей жизни организма и одинакова во всех ядерных клетках, что позволяет использовать для анализа практически любые клетки организма, полученные на разных стадиях онтогенеза.
Кроме того, с помощью ДНК-анализа поврежденный ген можно обнаружить не только при наличии развернутой клинической картины заболевания, но и до появления симптомов, а также у здоровых гетерозиготных носителей мутации в гене.
Предметом ДНК-диагностики может быть как исследование гена с целью выявления мутаций (прямой подход ДНК-диагностики), так и анализ сегрегации заболевания в определенной семье с полиморфными участками ДНК (маркерными локусами), тесно сцепленными с поврежденным геном {косвенный подход ДНК-диагностики). Прямая и косвенная ДНК-диагностика основана на методах, позволяющих идентифицировать небольшой, но строго определенный фрагмент ДНК человека. Обычно для этого используют блот-гибридизацию либо амплификацию с последующим анализом полученных образцов ДНК при помощи электрофореза в агарозном или полиакриламидном гелях или радиоавтографии.
Прямые методы ДНК-диагностики используются в тех случаях, когда известен ген, ответственный за возникновение наследственного заболевания и основные типы его патологических мутаций. Использование прямых методов ДНК-диагностики целесообразно для таких заболеваний как муковисцидоз (мажорная мутация delF508), фенилкетонурия (R408W), хорея Гентингтона (экспансия CTG-повторов) и ряда других.
Главное преимущество прямого метода - это высокая, практически 100%, точность диагностики и отсутствие необходимости ДНК-анализа всех членов ядерной семьи. Обнаружение мутации в соответствующем гене позволяет абсолютно точно подтвердить диагноз наследственного заболевания и определить генотип всех членов отягощенной семьи. Еще одно достоинство прямой диагностики - возможность выявления гетерозиготного носительства патологических мутаций у родителей умершего больного и его родственников, что особенно актуально для аутосомно-рецессивных заболеваний.
Основной недостаток прямых методов состоит в том, что для их применения требуется знание точной локализации патологического гена в геноме, его экзон-ин-тронной структуры и спектра его мутаций. Такая информация на сегодняшний день доступна далеко не для всех моногенных болезней человека.
К недостаткам прямых методов следует также отнести их неполную информативность, что связано с наличием широкого спектра патологических мутаций водном и том же гене, обусловливающих развитие наследственного заболевания. В зависимости от объема спектра мутаций в определенном гене, эта информативность может широко варьировать. Часть семей в этом случае остается не информативной для диагностики. Таблице дает представление об информативности прямых методов для различных заболеваний.
Косвенные методы ДНК-диагностики применяют в том случае, если ген, повреждение в котором приводит к заболеванию, не идентифицирован, а лишь локализован на определенной хромосоме, или когда методы прямой ДНК-диагностики не дают результата, (например, при значительной протяженности и сложной молекулярной организации гена, а также широком спектре патологических мутаций в нем). Косвенные методы ДНК-диагностики основаны на анализе сегрегации в семье аллелей полиморфных маркеров, находящихся в том же хромосомном регионе или тесно сцепленных с локусом заболевания.
Полиморфные маркеры, используемые для косвенной ДНК-диагностики, представляют собой точковые замены, делеции/инсерции, повторы, полиморфизм которых обусловлен различным количеством элементов в блоке,
Наиболее удобными для косвенной ДНК-диагностики признаны микросателлитные (мономер до 5 п.н.) и минисателлитные (мономер повтора состоит из 5—60 п.н.) полиморфные маркеры, широко распространенные в геноме человека. Для абсолютнога большинства известных в настоящее время полиморфных сайтов такого типа был строго показан менделевский характер наследования. Наиболее типичными среди микросателлитов являются динуклеотидные повторы, а самым распространенным из них - «СА»- повтор. Показано, что кластеры «СА»-повгоров встречаются в геноме в среднем каждые 30 тысяч нуклеотидных пар.
Во многих кластерах присутствует от 10 до30 динуклеотидных повторов и типичное количество аллелей составляет 4-8, что обеспечивает высокую информативность маркера.
Для количественной оценки информативности данного маркера введена величина, получившая название информационного содержания полиморфизма (PIC — от англ. polimorphism information content), которая вычисляется по следующей формуле:
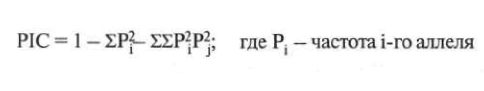
Эта величина определяет вероятность того, что изучение генотипа ребенка из исследуемой семьи и его родителей с помощью полиморфного маркера позволит определить: с каким из аллелей в данной семье сцеплено повреждение.
Ценность полиморфного маркера для ДНК-диагностики зависит не только отего информативности, но и генетического расстояния между маркером и повреждением в гене, так как точность оценки генетического риска в значительной степени определяется частотой рекомбинации между сайтом повреждения и полиморфным локусом.
Применение косвенных методов молекулярной диагностики предусматривает также в качестве обязательного предварительного этапа исследование частоты атлелей соответствующих полиморфных сайтов в анализируемых популяциях, среди больных и гетерозиготных носителей мутаций, а также определение вероятности рекомбинации и неравновесия по сцеплению между маркерными сайтами и мутантными аллелями гена.
Таким образом, основной недостаток косвенных методов заключается в их не 100%-ной точности. Действительно, возможная ошибка обусловлена вероятными рекомбинациями между изучаемым полиморфным локусом и повреждением в гене, а величина этой ошибки определяется двумя факторами: генетическим расстоянием между полиморфным локусом и мутацией, приводящей к заболеванию, и генетическим размером самого гена. Очевидно, что для уменьшения ошибки необходимо использовать маркеры расположенные непосредственно вблизи гена или даже внутри него.
Однако, часто размер критической области локализации гена составляет несколько сантиморганид, кроме того существуют гены, имеющие генетический размер 3-5 сантиморганид (например ген дистрофина). Для таких генов даже при использовании внутригенных маркеров величина ошибки составит 2—3% на мейоз. С возрастанием числа анализируемых мейозов ошибка будет накапливаться. Вообще, точный расчет генетического риска при проведении косвенной диагностики представляет собой довольно сложную математическую задачу. Типичная ошибка при проведении косвенной диагностики составляет 1-5%.
К недостаткам косвенной диагностики следует отнести необходимость семейного анализа и обязательную уверенность в клиническом диагнозе, так как ни подтвердить, ни опровергнуть его при использовании этих методов (в отличие от прямых) невозможно. Кроме того, косвенные методы ДНК-диагностики могут быть применены только для монолокусных заболеваний и неэффективны для моногенных по-лилокусных болезней. Действительно, для таких заболеваний существует несколько локусов, в которых необходимо проводить сегрегационный анализ и не ясно, какой из локусов выбрать.
Косвенные методы не требуют знания структуры гена и спектра мутаций в нем. Необходимо только иметь сведения о его локализации. В этом состоит основное преимущество этих методов. Кроме того, методы косвенной диагностики информативны практически для всех обратившихся семей, поскольку всегда есть возможность среди полиморфных маркеров, сцепленных с локусом заболевания, найти информативный для данной семьи.
Золотой стандарт ДНК-диагностики на сегодняшний день - комплексное использование и прямых и косвенных методов в каждом конкретном случае: подтверждение результатов косвенной диагностики результатами прямой, и наоборот. Такой подход позволяет получить наиболее точный и адекватный результат.
- Читать далее "Хромосомные синдромы. Классификация хромосомных аномалий у человека."
Оглавление темы "Анализ хромосом человека. Аномалии хромосом человека.":1. Картирование наследственных заболеваний. Методы картирования наследственных заболеваний.
2. Локусы генов. Генетическое расстояние между двумя локусами.
3. Строение хромосом человека. Классификация хромосом человека.
4. Анализ кариотипа человека. Цитогенетический метод анализа хромосом человека.
5. Молекулярно-цитогенетические методы анализа кариотипа человека. Нормальный кариотип человека.
6. Биохимические методы диагностики наследственных болезней. Иммуно-гистохимический метод.
7. Молекулярно-генетические методы диагностики наследственных заболеваний.
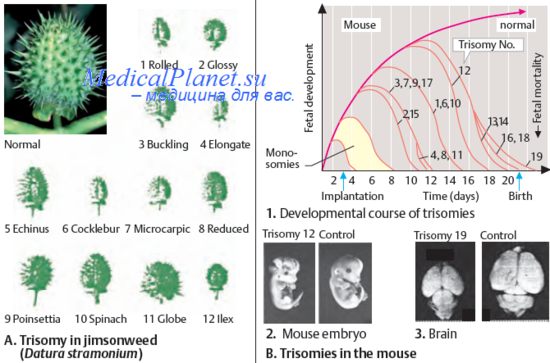
8. Хромосомные синдромы. Классификация хромосомных аномалий у человека.
9. Межхромосомные перестройки. Реципрокные транслокации. Робертсоновские транслокации.
10. Численные аномалии хромосом. Структурные аномалии хромосом.

