Строение и функции субкорнеальных слоев эпидермиса
Несмотря на то что роговой слой считается наиболее важным компонентом физического барьера, нижние слои эпидермиса также играют значительную роль в барьерной функции. После удаления рогового слоя с помощью клейкой ленты наблюдается незначительное или умеренное возрастание ТЭПВ, в то время как отделение целостного эпидермиса методом вакуумной аспирации приводит к серьезному нарушению барьерной функции. Потеря рогового и частично зернистого слоев при синдроме стафилококковой обожженной кожи, как правило, не представляет угрозы для жизни.
В свою очередь заболевания с образованием пузырей в супрабазальной и субэпидермальной зонах, такие как вульгарная пузырчатка, токсический эпидермальный некролиз (синдром Лайелла) и тяжелые ожоги, являются угрожающими жизни состояниями, если они сопровождаются поражением обширных участков поверхности кожи. В подобных случаях пациенты могут умереть вследствие обезвоживания или сепсиса, вызванного внешней бактериальной инфекцией, что непосредственно связано с нарушением барьерной функции. Значительно повысить вероятность выживаемости в таких обстоятельствах возможно путем создания искусственного барьера — используя пленку или жирную мазь, включающую активные антимикробные компоненты.
Данное клиническое наблюдение подтверждает значимость нижних слоев эпидермиса для осуществления двунаправленной барьерной функции — функции предотвращения избыточной потери воды и защиты от попадания вредных веществ в кожу.
а) Плотные межклеточные контакты - вторая линия эпидермального барьера. Плотные межклеточные контакты представляют собой участки герметического соединения соседних клеток, контролирующие околоклеточное перемещение молекул, отделяя апикальную часть клетки от базолатеральной (функция ограждения). Наиболее важными белками плотных межклеточных контактов в эпидермисе человека являются окклудин, клаудины и белки окклюзионной зоны (zonal occluding proteins, от лат. zona occludens — плотные межклеточные контакты).
Локализация окклюдина ограничена зернистым слоем, белок окклюзионной зоны-1 и клаудин-4 находятся в супрабазальных слоях, а клаудины 1 и 7 встречаются во всех слоях эпидермиса. При заболеваниях с нарушением барьерной функции рогового слоя, таких как вульгарный псориаз, плоский лишай, острая и хроническая экзема и вульгарный ихтиоз, белки плотных межклеточных контактов, локализация которых в норме ограничена зернистым слоем и верхней частью шиповатого слоя, обнаруживались также в более глубоких слоях эпидермиса. Мыши с дефицитом клаудина-1 умирают вследствие массивной потери жидкости в течение одного дня после рождения. Изменение барьерной функции кожи наблюдалось также и у мышей с избыточной экспрессией клаудина-6 в эпидермисе.
б) Структура межклеточных контактов и белки десмосом. Нарушение барьерной функции рогового слоя отмечается также в результате изменения в белках десмосом. Десмоглеины и десмосомные катедрины играют ведущую роль в стабилизации межклеточной адгезии в живых слоях эпидермиса. Аутоантитела к данным трансмембранным гликопротеинам вызывают пузыри при вульгарной пузырчатке вследствие отсутствия адгезии кератиноцитов. Острая экзема, при которой нарушается барьерная функция эпидермиса, характеризуется уменьшением Е-кадгерина в мембране кератиноцитов на участках спонгиоза. У трансгенных мышей с одинаковым распределением десмоглеина 3 в эпидермисе и в слизистой оболочке, происходило резкое увеличение трансмембранной потери воды, что приводило к смерти от обезвоживания в первую неделю жизни.
Те мыши, в эпидермисе которых был целенаправленно инактивирован Е-кадгерин, умирали сразу после рождения вследствие неспособности сохранить барьерную функцию и предотвратить потерю жидкости. Отсутствие Е-кадгерина является причиной неправильной локализации важнейших белков плотных межклеточных контактов, что делает данную зону адгезии проницаемой, приводя к нарушению барьерной функции эпидермиса.
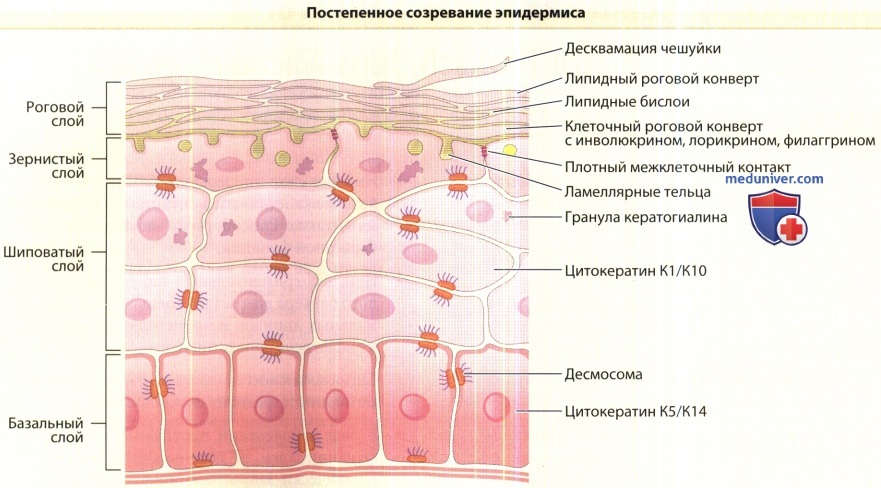
В базальный слой клеток добавьте, пожалуйста, полудесмосому к базальной мембране.
Пластинчатые тела должны быть заштрихованы (в том числе мембрана, объединяющая в форме сумки пластинчатые тела).
в) Коннексины - внутриклеточные фильтры. Коннексины являются трансмембранными белками, которые полимеризуются как гомо- или гетеромеры на плазмолемме, формируя коннексон. Коннексоны соседних клеток объединяются, образуя щелевые контакты, обеспечивающие прохождение между клетками ионов и малых молекул. Коннексин-26 — один из наиболее сильно экспрессированных генов в псориатических бляшках. Миссенс-мутации в гене коннексина-26 приводят к развитию пяти характерных ихтиозоподобных кожных заболеваний. У мышей с избыточной экспрессией коннексина-26 отмечалось состояние гиперпролиферации, инфильтрация иммунных клеток и замедленное восстановление эпидермального барьера.
г) Протеазы. Протеазы важны для дифференцировки эпидермиса. Прочность рогового конверта обусловлена образованием очень стабильных изопептидных связей, катализируемых трансглютаминазами-1, 3 и 5. Мыши с дефицитом трансглютаминазы-1 демонстрировали дефекты рогового слоя, умирая вскоре после рождения. При пластинчатом ихтиозе выявлены мутации в гене трансглютаминазы-1. В биосинтезе трансглютаминазы-1 принимает участие катепсин D. У мышей с дефицитом катепсина D отмечались нарушение барьерной функции и гиперпролиферация. Есть основания полагать, что цистатин М/Е и катепсин L являются первыми протеазами катепсин-D-трансглутаминаз-ного пути и что они сосуществовуют в жестко регулируемом балансе с целью поддержания целостности тканей эпидермиса, волосяных фоликулов и эпителия роговицы.
Существуют также данные, что разрушение цистатин-М/Е-катепсинового пути способствует нарушению функции кожного барьера, характерной для таких воспалительных дерматозов, как псориаз и атопический дерматит.
Синдром Нетертона — тяжелый аутосомно-рецессивный наследственный генодерматоз—обусловлен мутациями в SPINK5 — гене, кодирующем ингибитор сериновых протеаз LEKTI. При синдроме Нетертона часто наблюдается напоминающее атопическую экзему кожное заболевание, которое характеризуется нарушением барьера проницаемости. Мыши с дефицитом SPINK 5-/- воспроизводят основные признаки синдрома Нетертона, включая изменения десквамации, нарушение кератинизации, аномалии волос и дефект кожного барьера. Нехватка LEKTI ведет к аномальному расщеплению десмосом в верхнем зернистом слое, что обусловлено распадом десмоглеина-1 вследствие гиперакгивности химотрипсин-подобного фермента рогового слоя. Это приводит к нарушению адгезии рогового слоя и в итоге — к повреждению барьерной функции кожи.
д) Цитокиновая сигнализация: регуляция гомеостаза эпидермиса и его восстановление. Цитокины играют значительную роль в процессе заживления ран, на завершающем этапе которого происходят реэпителизация и дифференцировка, необходимые для формирования полноценного кожного барьера. Подобно иммунным клеткам кератиноциты способны производить множество разнообразных цитокинов. Особое значение имеют так называемые первичные цитокины: фактор некроза опухоли (ФНО), интерлейкин (ИЛ)-1 и ИЛ-6. Цитокины ИЛ-1, ФИО и ИЛ-6 являются сильнодействующими митогенами и стимуляторами липидного синтеза в коже и внекожных тканях. В результате острого нарушения барьера проницаемости происходит увеличение экспрессии ФИО, ИЛ-1 и ИЛ-6 на матричной РНК и повышение уровня экспрессии белков.
У мышей, лишенных ФНО-рецептора 1 или с двойным нокаутом ИЛ-1 рецептора 1/ФНО-рецептора 1, а также у мышей с дефицитом ИЛ-6, обнаружена задержка формирования проницаемого кожного барьера. Более того, эксперименты показали, что местное применение ФИО ускоряет восстановление барьера проницаемости, а местное применение ИЛ-6 у мышей с дефицитом ИЛ-6 способствует нормализации скорости проницаемости. У мышей с дефицитом рецептора-1 ФИО замедляется выработка липидов, необходимых для воссоздания кожного барьера, и понижается активность кислотной сфингомиелиназы, производящей церамиды для восстановления барьерной функции. В результате нарушения барьерной функции у мышей дикого типа наблюдается фосфорилизация тирозина STAT3, в то время как у мышей с дефицитом ИЛ-6 этот процесс носит крайне ограниченный характер. Резкое возрастание ФНО, ИЛ 1 и ИЛ-6, происходящее вследствие нарушения кожного барьера, имеет решающее значение для восстановления барьерной функции кожи.
Однако в случае если нарушение барьера сохраняется в течение долгого времени и приводит к хроническому возрастанию производства цитокинов, повышается опасность воспаления и усиления пролиферации эпидермиса. Нарушение барьера проницаемости, гиперпролиферация эпидермиса и воспаление часто являются осложнениями таких заболеваний, как ирри-тантный и аллергический контактный дерматит, атопический дерматит и псориаз.
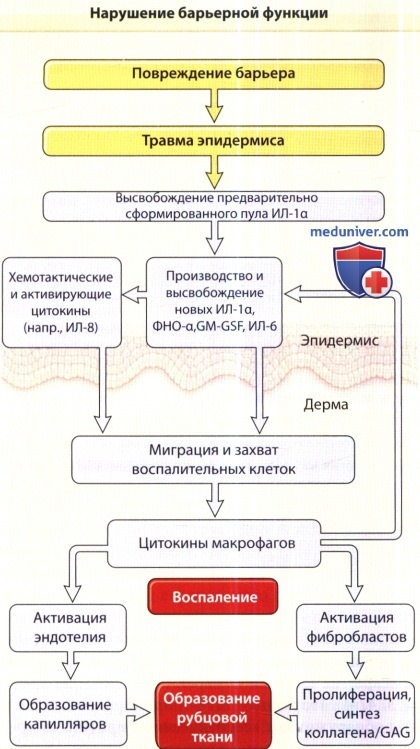
но также влияет и на процессы в дерме, что может стать причиной воспаления и развития рубцовой ткани в случае разрушения дермы.
GAG = гликозаминогликан; GM-GSF = колониестимулирующий фактор гранулоцитов-макрофагов;
ИЛ = интерлейкин; ФНО = фактор некроза опухоли.
е) Ионная модуляция - уровни кальция и калия в эпидермисе. В том случае, если место повреждения кожи подвергается воздействию изотонического, гипер- или гипотонического раствора, восстановление нарушенного кожного барьера происходит с обычной скоростью. Если же раствор содержит и калий, и кальций, то восстановление барьера замедляется. Существует градиент кальция в эпидермисе: в зернистом слое концентрация кальция наиболее высока, относительно низкий уровень кальция характерен для базального слоя и еще более низкий — для шиповатого слоя. Крайне ограничено содержание кальция в роговом слое, поскольку относительно сухой роговой слой с внеклеточными липидами не способен растворять высокополярные ионы. В результате нарушения барьера проницаемости происходит приток воды в роговой слой, что ведет к потере ионного градиента. Данная деплеция кальция регулирует экзоцитоз ламеллярных телец.
Кальций является важным регулятором синтеза белков в эпидермисе, в частности он контролирует активность трансглютаминазы-1. Кроме того, ионы внеклеточного кальция имеют большое значение для межклеточной адгезии и дифференцировки эпидермиса. Уровень внутриклеточного кальция регулируется не одним механизмом, о чем свидетельствуют два генетических заболевания, обсуждаемых ниже.
Нарушение регуляции метаболизма кальция и увеличение ТЭПВ наблюдается при болезни Дарье, для которой характерна утрата адгезии между клетками супрабазальных слоев эпидермиса в сочетании с аномалиями кератинизации, а также при болезни Хейли-Хейли, сопровождающейся потерей адгезии между клетками эпидермиса. Ген болезни Дарье (АТР2А2) кодирует аденозинтрифосфатазу сакроэндоплазматической сети (SERCA2) —фермент, обеспечивающий транспорт кальция; в свою очередь, ген Хейли-Хейли (АТР2С1) кодирует секрецию АТФ-азы в аппарате Гольджи (SPCA1) — механизм, ответственный за транспорт калия и магния.
ж) Нейротрасмиттеры в кератиноцитах (общность происхождения головного мозга и кожи). Находящиеся в кератиноцитах нейротрансмиттеры способны регулировать функцию барьера проницаемости. Рецепторы нейротрансмиттеров подразделяются на две группы: (1) ионотропные рецепторы (ионы кальция или хлорида) и (2) рецепторы, сопряженные с G-белком. Местное применение агонистов кальциевых каналов замедляет восстановление кожного барьера, в то время как антагонисты оптимизируют нормализацию барьерной функции.
Сопряженные с G-белком рецепторы регулируют внутриклеточный уровень циклической аденозинмонофосфатазы (цАМФ). Повышение внутриклеточного уровня цАМФ в эпидермальных кератиноцитах затормаживает восстановление барьера; в свою очередь антагонисты цАМФ ускоряют данный процесс. Активация допамин 2-подобных рецепторов, рецепторов мелатонина или рецептора серотонина (типа 5НТ1) понижает уровень цАМФ в клетке и, таким образом, способствует восстановлению барьера; активация адренергических β2- рецепторов повышает внутриклеточный уровень цАМФ, тем самым замедляя воссоздание нарушенного барьера. Многие из агонистов или антагонистов трансмиттерных рецепторов применяются в лечении нервных расстройств; некоторые из них также могут быть эффективны при кожных заболеваниях.
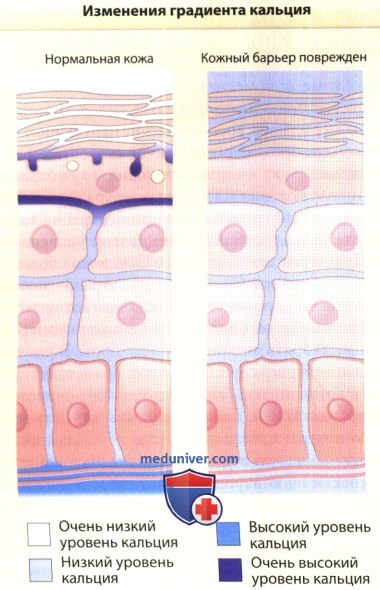
регулируют секрецию ламеллярных телец и дифференцировку эпидермиса.
- Рекомендуем далее ознакомиться со статьей "Кожный барьер как причина заболеваний кожи"
Оглавление темы "Гистология, физиология кожи.":
