Этапы синтеза коллагена и сборки коллагеновых волокон
а) От генов коллагена к супрамолкулярной сборке. Гены коллагенов, как и большинство эукариотных генов, представляют собой крупные мультиэкзонные гены, которые прерываются в нескольких точках некодирующими последовательностями ДНК, называемые интронами. Для экспрессии весь ген транскрибируется в прекурсорную матричную РНК (мРНК) с высоким молекулярным весом, которая подвергается посттранскрипционным модификациям, в частности кэппингу, полиадениляции и сплайсингу интронов, образуя линейную непрерывную кодирующую последовательность с нетранслированными боковыми участками 5' и 3'.
Зрелая мРНК транспортируется затем в цитоплазму и транслируется в соответствующий полипептид. Следовательно, генетическое кодирование белков эукариот намного объемнее, чем можно было предсказать, исходя из аминокислотной последовательности итогового белка.
За немногими исключениями, гены коллагенов широко разбросаны по геному человека. Знание точной хромосомной локализации генов, кодирующих коллагены кожи человека, позволило идентифицировать полиморфные маркеры в генах и во фланговых ДНК, что применяется для исследований генетического сцепления. Кроме того, стратегии выявления сложных мутаций на основе сканирования генов привели к идентификации большого количества мутаций в различных генах коллагенов с характерными фенотипическими корреляциями.
В физиологических условиях фибриллобразующие молекулы коллагена спонтанно собираются в нерастворимые волокна. Это наблюдение представляло собой логическую задачу, поскольку трудно было визуально представить, как может молекула коллагена синтезироваться внутри клетки и затем секретироваться во внеклеточное пространство без досрочной сборки молекул в нерастворимые волокна. Решение было найдено, когда стало известно, что коллаген первоначально синтезируется в качестве крупной прекурсорной молекулы, проколлагена, растворимой в физиологических условиях.
Прекурсорные полипептиды проколлагена, так называемые пре-про-а-цепи, синтезируются на рибосомах шероховатой (гранулярной) эндоплазматической сети в фибробластах и родственных клетках. Являясь продуктом первоначальной трансляции, пре-про-а-цепь, включает аминотерминальную сигнальную (или лидерскую) последовательность, характерный признак многих секретируемых белков. Эта последовательность служит сигналом для прикрепления рибосом к мембранам шершавой эндоплазматической сети и векторного высвобождения образующихся пептидов в цистерны этой сети.
В ходе трансмембранного транспорта полипептидов сигнальная последовательность ферментативно удаляется в процессе реакции, которая катализируется сигнальной пептидазой, а полипептидазы, обозначаемые как про-а-цепи, выделяются в люмен шершавой эндоплазматической цепи. У некоторых типов коллагена, в частности у коллагенов, образующих фибриллы, про-а-цепи крупнее, чем a-цепи коллагенов, поскольку они содержат дополнительные пептидные последовательности на обоих концах молекулы.
б) Посттрансляционные модификации полипептидных цепей. После сборки аминокислот в пре-про-а-цепи на рибосомах, полипептиды подвергаются нескольким модификациям, прежде чем сформировавшиеся молекулы коллагена соберутся во внеклеточных волокнах. Большинство из этих реакций модификации катализируются специфическими ферментами, причем многие из модификаций характерны для биосинтеза коллагена. Реакции посттрасляционных модификаций коллагена включают:
1) синтез гидроксипролина путем гидроксилирования выбранных пролиновых остатков;
2) синтез гидроксилизина путем гидроксилирования выбранных лизиловых остатков;
3) прикрепление углеводородов, галактозы или глюкозилгалактозы к определенным гидроксилизиловым остаткам;
4) объединение цепей, образование дисульфидных связей и формирование тройной спирали;
5) протеолитческую конверсию проколлагена в коллаген и
6) образование волокон и перекрестных связей.
Современные данные указывают на то, что реакции модификации с 1-й по 4-ю являются внутриклеточными, в то время как протеолитическая конверсия, образование волокон и перекрестной связи происходят, вероятно, во внеклеточном пространстве.
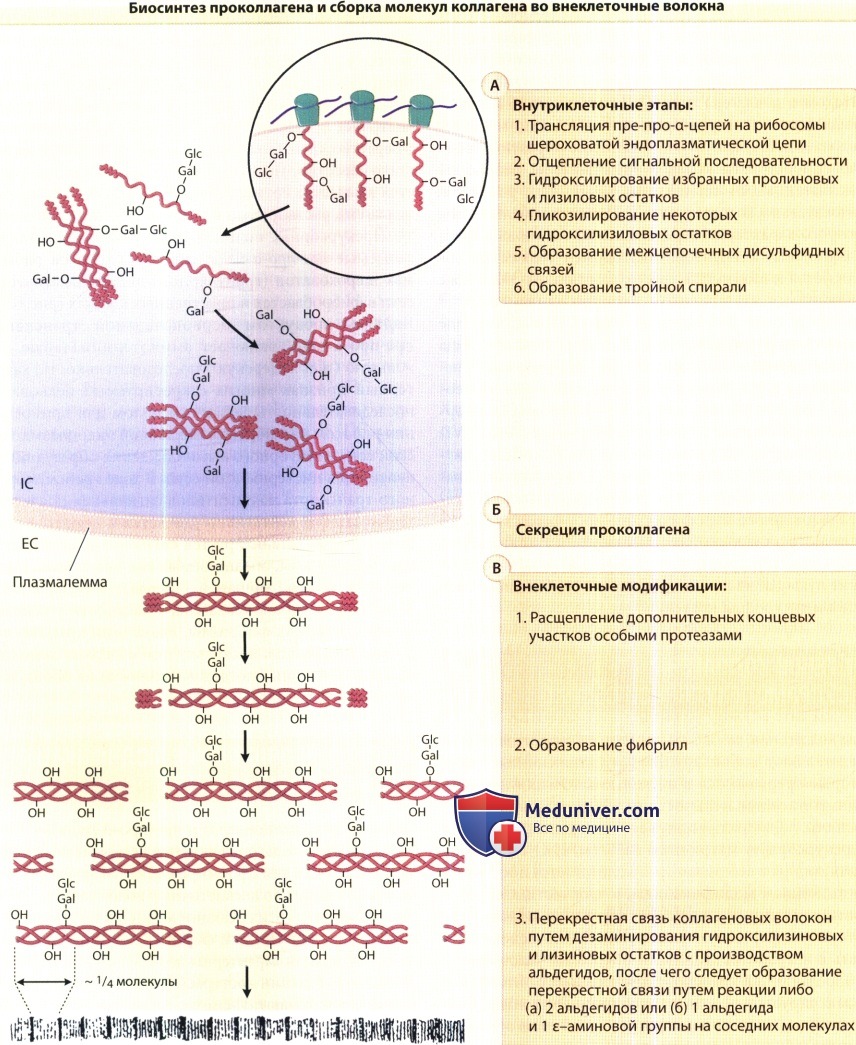
ЕС = внеклеточный; Gls-Gal = глюкозилгалактоза, присоединенная к гидроксилизиловому остатку;
IC = внутриклеточный; mRHA = матричная РНК;
-ОН = гидроксильная группа гидроксипролина или гидроксилизина; REP = шероховатая (гранулярная) эндоплазматическая сеть.
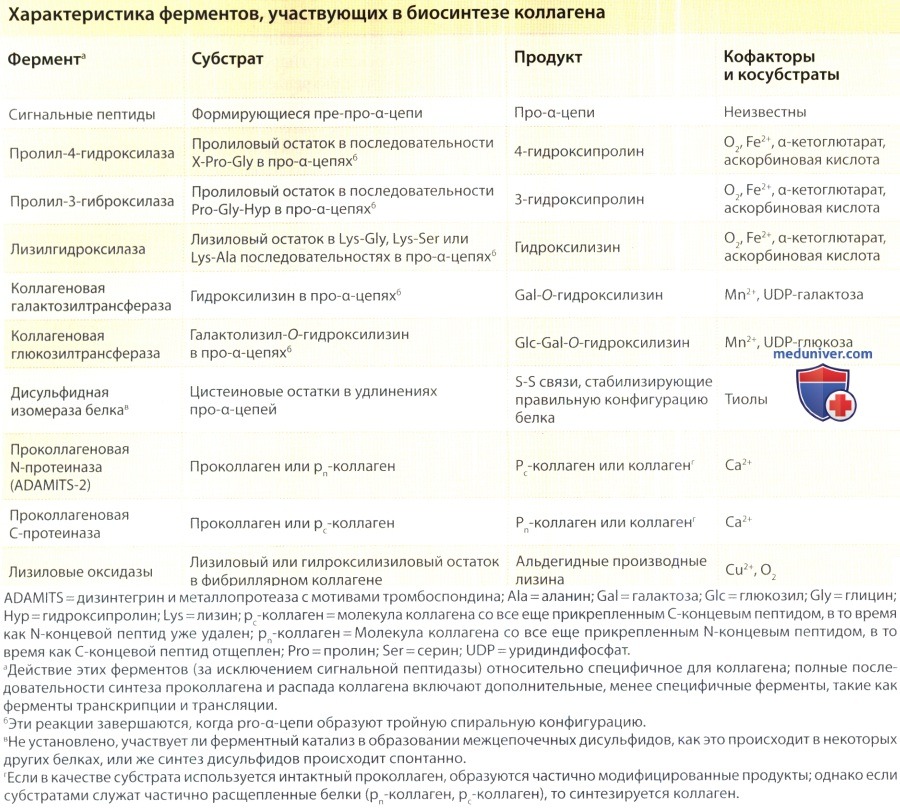
в) Синтез гидроксипролина, гидроксилизина и присоединение углеводов. Характерным признаком коллагенов является наличие гидроксипролиновых и гидроксилизиновых остатков. Свободные гидроксипролины и гидроксилизины не входят в формирующиеся пептидные цепи, а появляются в результате гидроксилирования пролиловых и лизиловых остатков. Реакции гидроксилирования катализируются ферментами, относящимися к семействам пролиловых и лизиловых гидроксилаз. Для этих ферментов требуется молекулярный кислород, двухвалентное железо, а-кетоглютарат и восстановитель, например аскорбат, в качестве косубстратов и кофакторов для реакций.
Гидроксилирование начинается, пока про-а-цепи растут на рибосомах, и завершается вскоре после высвобождения из рибосом полипептидных цепей полной длины. Гидроксипролин находится в коллагенах в форме двух изомеров: транс-3-гидрокси-1-пролина и транс-4-гидрокси-1-пролина (самый распространенный изомер). Критическое количество транс-4-гидрокси-1-пролина является предпосылкой для укладки а-цепей в тройную спираль, конфигурацию, необходимую для выделения молекул проколлагена из клеток.
Поскольку образование тройной спирали происходит в цистернах шероховатой (гранулярной) эндоплазматической цепи, синтез гидроксипролина должен быть завершен до того, как молекулы проколлагена покинут этот клеточный компартмент. Следовательно, в отсутствие гидроксипролина, важная трехспиральная структура коллагена в физиологических условиях не смогла бы образоваться, и функциональные коллагеновые волокна во внеклеточном пространстве не появились бы.
Для активности пролилгидроксилазы требуется редуцирующий агент, такой как аскорбат. Поэтому дефицит аскорбиновой кислоты приводит к уменьшению образования коллагеновых волокон. Этим объясняются некоторые клинические проявления при цинге, в частности, плохое заживление ран и пониженная эластичность соединительных тканей. Аналогичная ситуация может возникать и при гипоксии тканей, поскольку присутствие молекулярного кислорода является специфическим условием формирования гидроксильных групп в гидроксипролине.
Исследования в моделях на животных показывают, что заживление ран в гипобарических условиях происходит плохо, поскольку в таких ситуациях низкий уровень кислорода может приводить к ограничению синтеза гидроксипролина. Этим фактом можно также объяснить тенденцию к ухудшению заживления ран и язв в периферических тканях, которые лишены достаточного количества кислорода вследствие ухудшения кровоснабжения. Возможно это связано также с недавней оценкой пролиловых гидроксилаз как истинных кислородных сенсоров.
Вдобавок к пролил-4-гидроксилазе, играющей решающую роль в гидроксилировании пролиловых остатков, на формирующихся полипептидных цепях коллагена имеются дополнительные изоформы пролил-4-гидроксилазы, ответственные за гидроксилирование двух пролиновых остатков, которые маркируют а-субъединицу индуцируемого гипоксией транскрипционного фактора (главного регулятора индуцируемых гипоксией генов) для деградации протеасом.
Гидроксилирование лизила имеет решающее значение, поскольку гидролизиловые остатки служат либо как место прикрепления для галактозиловых и глюко-галактозиловых остатков в процессе внутриклеточного синтеза проколлагена, либо для образования перекрестных связей, стабилизирующих коллагеновый матрикс во внеклеточном пространстве.
Внутриклеточная модификация групп лизила является последовательным процессом и включает гидроксилирование лизила, вслед за которым происходит прикрепление галактозильного остатка к гидроксильной группе гидроксилизина с помощью О-гликозидной связи, а затем остаток глюкозы присоединяется к некоторым галактозильным остаткам.
Следовательно, синтез гидроксилизина является предпосылкой гликозилирования коллагенов. Имеются три изоформы лизилгидроксилазы, и одна из них, лизил-3-гидроксилаза обладает тройным действием как: (1) лизилгидроксилаза, (2) га-лактозилтранссфераза и (3) глюкозилтрансфераза. В реакциях гликозилирования используются уридиндифосфатные сахара в качестве источника углеводов, а в качестве кофактора необходим Mn2+. Дополнительно к гликозилированию гидроксилизиловых остатков в трехспиральном участке молекулы, неспиральные удлинения содержат сложные углеводы, состоящие главным образом из маннозы.
Дефицита лизилгидроксилазы у пациентов со сколиозной формой (типом IV) синдрома Элерса-Данлоса, для которого характерны гиперэластичность кожи, нестабильность суставов, тяжелый кифосколиоз и подверженность некоторым глазным заболеваниям. Недавно было идентифицировано заболевание соединительной ткани у человека, вызванное мутациями гена лизилгидроксилазы-3. Это заболевание ассоциируется с аномалиями нескольких органов, в том числе кожи, а признаки его фенотипа совпадают с рядом известных коллагеновых патологий.
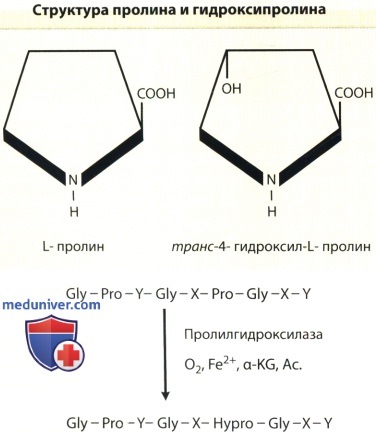
и схематическое изображение ферментативного гидроксилирования пролиловых остатков в У-позиции в составе повторяющейся полипептидной последовательности Gly-X-Y коллагена.
Ас = Аскорбиновая кислота; Gly = Глицин; a-KG = a-кетоглютарат.
г) Объединение цепей, дисульфидная связь и образование тройной спирали. Решающим этапом во внутриклеточном биосинтезе проколлагена является объединение трех про-а-цепей и последующее укладывание коллагенового участка полипептидов в тройную спираль. Неколлагеновые дополнительные последовательности пептидов на индивидуальных a-цепях приобретают глобулярную конфигурацию вскоре после трансляции, и эта конфигурация содержит специфическую информацию, которая управляет процессом правильного объединения трех про-α-цепей. Этим механизмом можно объяснить объединение про-α1 и про-α2-цепей в соответствующем соотношении 2:1 во время синтеза проколлагена типа I.
Этим же механизмом объясняется быстрое и эффективное объединение про-α-цепей и укладывание молекулы в тройную спираль. Связывание удлинений на карбоксильных концах полипептидных цепей облегчает укладывание молекулы в тройную спираль, обеспечивая, вероятно, место нуклеации, с которого образование тройной спирали продвигается через коллагеновый участок молекулы.
д) Конверсия проколлагена в коллаген. После выделения во внеклеточное пространство, молекулы проколлагена конвертируются в коллаген в процессе ограниченного протеолиза, в ходе которого удаляются дополнительные концевые пептиды. Конверсия проколлагена типа I в коллаген катализируется двумя специфическими ферментами: проколлагеновой N-протеиназой и проколлагеновой С-протеиназой, которые по отдельности удаляют аминотерминальный и карбоксильный терминальный концы молекулы соответственно. Кроме того, отдельным специфическим ферментом является N-протеиназа, которая катализирует конверсию проколлагена типа III в коллаген.
N-протеиназа, способная расщеплять проколлаген типа I, принадлежит к семейству внеклеточных протеаз ADAMTS (дизинтегрин и металлопротеаза с мотивами тромбоспондина), а именно ADAMS-2. Активность фермента зависит от нативной конфигурации аминотерминальных пептидов в проколлагене, поскольку фермент не катализирует отщепление дополнительных концевых пептидов от индивидуальных a-цепей. Кроме того, частично очищенная N-протеиназа ингибируется хелаторами металлов, что предполагает потребность в двухвалентных катионах.
С-протеиназа необходима для удаления карбоксильных терминальных пептидов у проколлагенов типов I, II, III и V, что позволяет подвергшимся полному процессингу молекулам образовать функциональные волокна. Клонирование С-протеиназы проколлагена типа I выявило, что она идентична костному морфогенетическому белку 1, металлопротеазе, которая участвует в структурообразовании в ходе развития различных организмов и способна также приводить к формированию эктопированной костной ткани. Активность С-протеиназы/костного морфогенетического белка I стимулируется усилителями проколлагеновой С-протеиназы, гликопротеинами, которые связываются с С-концевым пептидом проколлагена типа I.
Таким образом, конверсия проколлагена в коллаген представляет собой комплексный, строго контролируемый процесс, а если либо аминокислотные, либо карбоксильные терминальные пептидные последовательности не отщепляются, это приводит к нарушению растяжимости коллагеновых волокон к коже. В частности, недостаточное удаление аминокислотных терминальных пропептидов коллагена типа I in vivo вызывает дерматоспараксис, заболевание, связанное с хрупкостью кожи, первоначально обнаруженное у различных видов животных, а недавно и у людей. В частности, аналог заболевания у человека—дерматоспараксис по типу синдрома Элерса-Данлоса (тип VIIc), который вызывается недостаточной активностью N-протеиназы.
Следует отметить, что фенотипически сходное заболевание, артрохалазия по типу синдрома Элерса-Данлоса (тип VII а и VIIb), может вызываться мутациями в генах коллагена типа I (COL1A1 и COL1A2 соответственно) в месте расщепления N-протеиназы.
е) Сборка и перекрестное связывание коллагена. Сборка коллагена лучше всего изучена для фибриллярных коллагенов. После удаления дополнительных терминальных пептидов во внеклеточное пространство, молекулы коллагена спонтанно организуются в волокна. Однако эти волокна не обладают необходимой силой растяжимости до тех пор, пока не связываются вместе специфическими ковалентными связями, называемыми перекрестными. Наиболее распространенными формами перекрестных связей в коллагене являются лизиновые или гидроксилизиновые связи. Первым этапом образования перекрестных связей коллагена служит ферментативная конверсия некоторых лизиловых и гидроксилизиловых остатков в соответствующие альдегидные производные путем удаления эпсилон-аминовых групп.
Затем альдегиды образуют перекрестные связи в ходе двух типов реакций. Одна реакция заключается в конденсации альдегида с эпсилон-аминовой группой, все еще присутствующей в другом немодифицированном лизине или гидрокслизине, при этом образуется перекрестная ковалентная связь по типу шиффова основания. Второй тип реакции — адольная конденсация между двумя альдегидами. Кроме этих перекрестных связей, коллаген содержит несколько более сложных перекрестных связей, в которых также участвуют лизиловые или гидроксилизиловые остатки. Лизиновые и гидроксилизиновые перекрестные связи могут быть либо внутримолекулярными, когда они осуществляются между двумя соседними a-цепями в одной и той же молекуле коллагена, либо межмолекулярными, стабилизирующими организацию соседних молекул коллагена вдоль микрофибриллярных структур.
Первым этапом в перекрестном связывании коллагена является оксидативное дезаминирование некоторых лизиловых и гидроксилизиловых остатков, которое катализируется лизилоксидазой. Этому ферменту необходима медь в качестве кофактора, и его активность легко ингибируется нитрилами, такими как β-амино-проприонитрил, который вызывает латиризм у животных. Поскольку перекрестные связи обеспечивают силу растяжения, необходимую для некоторых тканей, дефект в образовании этих ковалентных связей может привести к нарушению функции соединительной ткани. Примером является синдром затылочного рога (ранее известный как синдром Элерса-Данлоса типа IX), который развивается вследствие уменьшения активности лизилоксидазы.
Первичный дефект заключается в нарушении метаболизма меди, вызванном мутациями в осуществляющем транспорт меди ферментном белке, аденозинтрифосфатазе, кодируемой геном MNK-1, причастном также к синдрому Менкеса. В результате уровень меди в сыворотке снижается, что приводит к понижению активности лизилоксидазы.
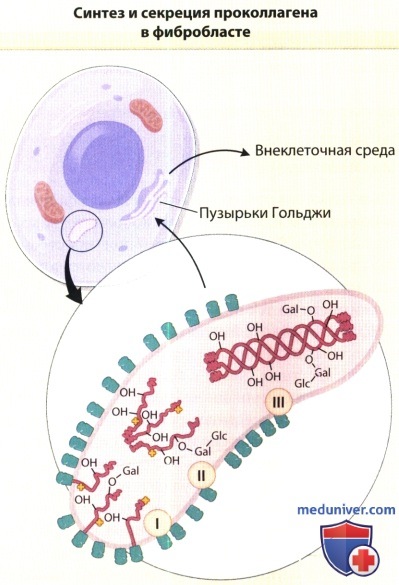
В увеличенном изображении представлены процессы, происходящие в шероховатой эндоплазматической сети клеток в ходе синтеза проколлагена.
На первом этапе (I) полипептидные цепи проколлагена синтезируются на мембранносвязанных рибосомах, и формирующиеся цепи направляются в цистерны шероховатой эндоплазматической сети.
На растущих полипептидных цепях начинается гидроксилирование пролиловых и лизиловых остатков и гликозилирование гидроксилизиловых остатков.
Эти реакции завершаются вскоре после высвобождения полноразмерных цепей из рибосом (II).
В процессе образования межцепочечных дисульфидных связей три про-а-цепи соединяются, и коллагеновые участки полипептидов приобретают конфигурацию тройной спирали (III).
Затем молекулы проколлагена перемещаются из шероховатой эндоплазматической цепи в пузырьки аппарата Гольджи и секретируются из пузырьков во внеклеточную среду.
— ОН = гидроксильные группы гидроксипролина и гидроксилизина; -Gal = галактозиловый остаток, присоединенный к гидроксилизину;
-Gal-Glc = глюкозилгалактозиловый остаток, присоединенный к гидроксилизину О-гликозидной связью; структуры в форме листа клевера обозначают гидроксилирующие и гликозилирующие ферменты.
- Рекомендуем далее ознакомиться со статьей "Контроль синтеза коллагена и внеклетомного матрикса (ВКМ)"
Оглавление темы "Внеклеточный матрикс (ВКМ) дермы.":
