Реакция лейкоцитов на воспаление - миграция и накопление
Важная функция воспалительной реакции заключается в накоплении в очаге повреждения лейкоцитов и их активации для элиминации повреждающих агентов. Лейкоциты при типичных воспалительных реакциях отвечают за фагоцитоз и представлены ней-трофилами и макрофагами, которые поглощают бактерии и другие микробы и элиминируют некротическую ткань и инородные субстанции. Цена этого защитного потенциала лейкоцитов высока.
При излишней активации лейкоциты, разрушающие бактерии и некротические ткани, могут повредить и нормальную ткань, вызвать ее вторичное повреждение и продлить воспаление.
Участие лейкоцитов в воспалительном процессе осуществляется в следующей последовательности:
(1) выход из кровотока через стенку сосуда в окружающую ткань;
(2) распознавание микробов и некротической ткани;
(3) фагоцитоз и удаление повреждающего агента.
Мобилизация лейкоцитов из просвета сосуда через его стенку в интерстициальную ткань (экстравазация) может быть разделена на несколько последовательных этапов:
- маргинация, роллинг и адгезия лейкоцитов к эндотелию в просвете сосуда. В норме сосудистый эндотелий в неактивном состоянии не адгезирует клетки из кровотока и не препятствует их проходу. При воспалении лейкоциты приклеиваются к эндотелию перед выходом из просвета сосуда через стенку;
- миграция лейкоцитов через слой эндотелия и стенку сосуда;
- миграция лейкоцитов в ткани под действием хемотаксической активации.
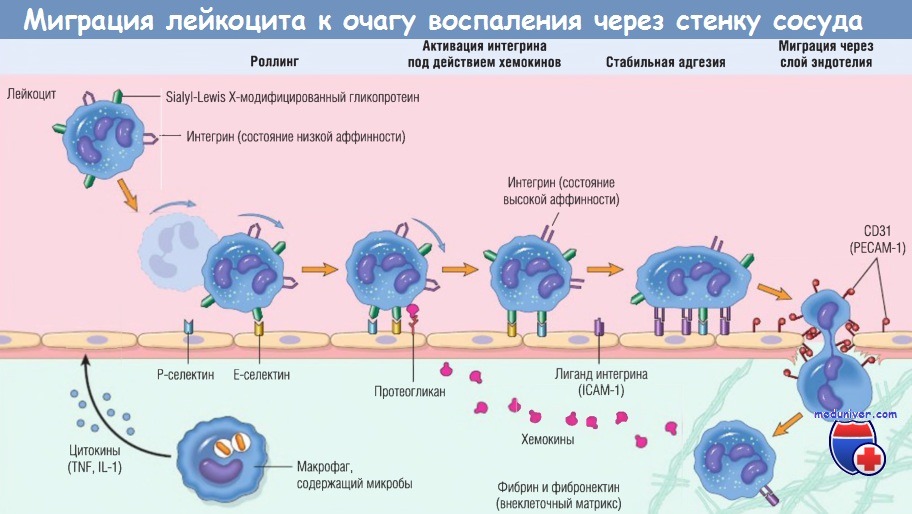
Сначала лейкоцит перекатывается по поверхности эндотелия, потом становится активированным и адгезируется к эндотелию, затем проходит сквозь него,
проникает через базальную мембрану и мигрирует в участок повреждения ткани под действием хемоаттрактантов.
На разных этапах этого процесса работают разные основные молекулы:
селектины — при роллинге, хемокины (обычно представленные в связанном виде с протеогликанами) — при активации нейтрофилов для повышения сродства интегринов,
интегрины — для стойкой адгезии, CD31 (РЕСАМ-1) — для трансмиграции. Нейтрофилы экспрессируют низкие уровни L-селектина;
они связываются с эндотелием преимущественно через Р- и Е-селектины.
ICAM-1 — молекула межклеточной адгезии 1; IL — интерлейкин; РЕСАМ-1 — тромбоцитарная молекула адгезии эндотелиальных клеток 1; TNF — фактор некроза опухоли.
а) Маргинация, роллинг и адгезия лейкоцитов к эндотелию в просвете сосуда. При нормальном венозном кровотоке эритроциты движутся в центре потока крови, оттесняя лейкоциты к стенке сосуда. Поскольку уже на ранних стадиях воспаления кровоток замедляется (стаз) и меняются гемодинамические условия (падает напряжение сосудистой стенки), то все большее количество лейкоцитов занимает периферическую позицию в кровотоке вдоль поверхности эндотелия.
Этот процесс перераспределения лейкоцитов называют маргинацией. Далее отдельные лейкоциты или их скопления ненадолго прилипают к эндотелию, отделяются и опять прилипают, как бы перекатываясь по стенке сосуда. Такое перемещение лейкоцитов вдоль сосудистой стенки называют роллингом. В некоторой точке клетка останавливается и в этот момент плотно прилипает к эндотелию (происходит адгезия).
Адгезия лейкоцитов к эндотелиальным клеткам опосредована молекулами адгезии, экспрессию которых на обоих типах клеток усиливают секретирован-ные белки — цитокины. Цитокины секретиру-ются клетками тканей в ответ на появление микробов или других повреждающих агентов, тем самым обеспечивая миграцию лейкоцитов в места присутствия этих агентов.
Начальные роллинговые взаимодействия опосредованы семейством белков селектинов. Существует три типа селектинов: один экспрессируется на лейкоцитах (L-селектин), другой — на эндотелии (Е-селектин), а третий — на тромбоцитах и эндотелии (Р-селектин). Лиганды к селектинам — это сиалированные олигосахариды, связанные с муциноподобными гликопротеиновыми структурами. Экспрессия селектинов и их лигандов регулируется цито-кинами, продуцируемыми в ответ на инфекционное повреждение.
Тканевые макрофаги, тучные клетки и эндотелиальные клетки первыми взаимодействуют с микробами и некротической тканью и реагируют, секретируя несколько цитокинов, в т.ч. TNF, интерлейкин-1 (IL-1) и хемокины (хемотак-сические цитокины, хемоаттрактанты). TNF и IL-1, выявляемые на эндотелиальных клетках посткапиллярных венул, соседствующих с инфекцией, индуцируют скоординированную экспрессию множества молекул адгезии. В течение 1-2 час эндотелиальные клетки начинают экспрессировать Е-селектин и лиганды к L-селектину.
Другие медиаторы, такие как гистамин, тромбин и фактор активации тромбоцитов, описанные далее, стимулируют перераспределение Р-селектина из его обычного внутриклеточного депо в гранулах эндотелиоцитов (названных тельцами Вейбеля-Паладе) на поверхность клетки. Лейкоциты экспрессируют L-селектин, а также лиганды к Е- и Р-селектинам, все они связываются с молекулами на эндотелиальных клетках. Эти низкоаффинные связи легко разрушаются под действием сил кровотока. В результате связанные лейкоциты прилипают, отделяются, опять прилипают, таким образом перемещаясь по поверхности эндотелия.
Слабые роллинговые связи позволяют лейкоцитам замедлить ход и связаться с эндотелием более прочно. Плотность адгезии опосредована семейством лейкоцитарных поверхностных гетеродимерных белков интегринов. TNF и IL-1 индуцируют экспрессию эндотелиальными клетками лигандов к интегринам, в основном к молекулам адгезии сосудистого эндотелия 1 (VCAM-1) (для интегрина VLA-4) и к молекулам межклеточной адгезии 1 (ICAM-1) (для интегринов LFA-1 и Мас-1). В норме лейкоциты экспрессируют интегрины с низкой аффинностью.
Тем временем хемокины, образованные в месте повреждения, попадают в просвет сосуда, прикрепляются к протеогликанам эндотелиальных клеток и концентрируются на поверхности эндотелия. Эти хемокины связываются и активируют роллинговые лейкоциты. В результате лейкоцитарные интегрины VLA-4 и LFA-1 превращаются в высокоаффинные. Комбинация цитокин-индуцированной экспрессии лигандов интегринов на эндотелии и активация лейкоцитарных интегринов приводит к плотному интегрин-опосредованному сцеплению лейкоцитов с эндотелием в очаге воспаления. Лейкоциты перестают перемещаться, их цитоскелет реорганизуется, и они распределяются по эндотелиальной поверхности.
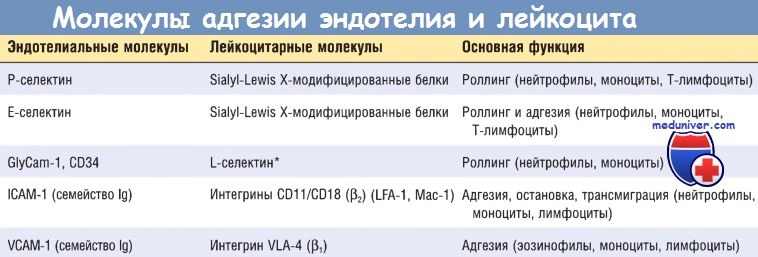
ICAM-1 — молекулы межклеточной адгезии 1; lg — иммуноглобулин; VCAM-1 — молекулы адгезии сосудистого эндотелия 1.
б) Миграция лейкоцитов через слой эндотелия и стенку сосуда. Следующий этап в процессе мобилизации лейкоцитов — трансмиграция, или диапедез (миграция лейкоцитов через слой эндотелия). Трансмиграция происходит преимущественно в посткапиллярных венулах. На адгезированные лейкоциты действуют хемокины, стимулируя выход лейкоцитов через межэндотелиальные пространства в соответствии с градиентом концентрации хемокинов и перемещение к месту раны или инфекции, где хемокины были образованы. В процессе миграции лейкоцитов участвуют несколько молекул, располагающихся в межклеточных соединениях между эндотелиальными клетками.
Эти молекулы включают тромбоцитарную молекулу адгезии эндотелиальных клеток 1 (РЕСАМ-1), или CD31, из суперсемейства Ig и несколько молекул адгезии. После прохождения через эндотелий лейкоциты просачиваются через базальную мембрану (возможно, за счет выделения коллагеназ) в окружающую сосуды ткань. Затем клетки мигрируют по градиенту концентрации хемокинов и накапливаются вне сосуда. В соединительной ткани лейкоциты адгезируются к ВКМ за счет способности интегринов и CD44 связываться с белками матрикса. Таким образом лейкоциты попадают в нужное место.
Наиболее яркое доказательство важности лейкоцитарных молекул адгезии — существование генетических дефектов этих молекул, приводящих к интеркур-рентным бактериальным инфекциям, развивающимся вследствие нарушения адгезии лейкоцитов и недостаточной воспалительной реакции. Индивиды с дефицитом адгезии типа I имеют нарушения биосинтеза b2-цепи, общей для интегринов LFA-1 и Мас-1. Дефицит адгезии типа II вызывается отсутствием sialyl-Lewis X (фукозосодержащего лиганда к Е- и Р-селектинам) в результате дефекта фукозилтрансферазы — фермента, присоединяющего части фукозы к белковым каркасам.
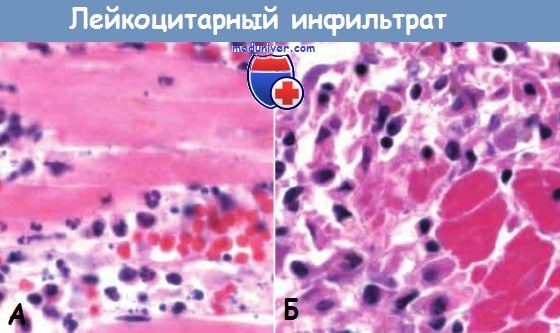
Ранняя (нейтрофильная) (А) и поздняя (мононуклеарная)
(Б) фазы образования инфильтрата в зоне демаркационного воспаления при инфаркте миокарда.
в) Миграция лейкоцитов в ткани под действием хемотаксической активации. После выхода из просвета сосуда лейкоциты направляются в очаг повреждения. Этот процесс называют хемотаксисом. Хемоаттрактантами могут быть и экзогенные, и эндогенные субстанции. Самые распространенные экзогенные агенты — продукты бактерий, в т.ч. пептиды, которые имеют в своем составе концевую аминокислоту N-формилметионин и некоторые липиды. Эндогенные хемоаттрактанты включают следующие химические медиаторы воспаления:
(1) цитокины, особенно семейства хемокинов (например, IL-8);
(2) компоненты системы комплемента, особенно С5а;
(3) метаболиты арахидоновой кислоты, в основном лейкотриен В4.
Все эти хемотаксические агенты связываются со специфическими 7-трансмембранными G-белок-связанными рецепторами на поверхности лейкоцитов. Сигналы, передающиеся через эти рецепторы, активируют вторичные мессенджеры, повышающие уровень кальция в цитозоле и, в свою очередь, активирующие малые гуанозинтрифосфатазы семейства Rac/Rho/cdc42 и множество киназ. Эти сигналы вызывают полимеризацию актина, приводящую к увеличению его количества в передней части клетки и оттеснению миозиновых филаментов назад.
Лейкоцит передвигается, образуя свои филоподии, которые тянут заднюю часть клетки в направлении движения, как автомобиль с передним приводом. В конечном итоге лейкоцит мигрирует к агенту воспаления в соответствии с градиентом концентрации локально продуцируемых хемоаттрактантов.
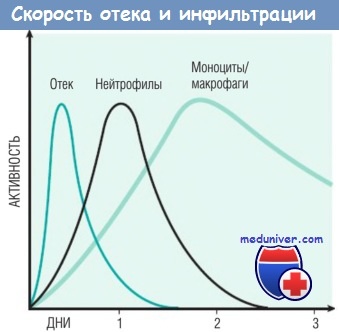
Природа лейкоцитарного инфильтрата варьирует в зависимости от длительности воспаления и типа его агента. При большинстве форм острого воспаления в воспалительном инфильтрате в первые 6-24 час доминируют нейтрофилы, через 24-48 час они заменяются моноцитами. Есть несколько причин для раннего появления нейтрофилов: они самые многочисленные в крови; быстрее реагируют на хемокины и могут более плотно прикрепляться к адгезивным молекулам, таким как Р- и Е-селектины. Нейтрофилы имеют короткий период жизни: после выхода в ткани подвергаются апоптозу и исчезают в течение 24-48 час. Моноциты могут не только дольше сохраняться в тканях, но и делиться посредством митоза, становясь доминирующей популяцией клеток при хроническом воспалении.
Однако есть исключения. При определенных инфекциях, например синегнойной, клеточный инфильтрат представлен преимущественно нейтрофилами, при вирусных инфекциях первыми клетками, появляющимися в воспалительном инфильтрате, могут быть лимфоциты, а при некоторых реакциях гиперчувствительности основными клетками инфильтрата могут быть эозинофилы.
Понимание молекулярных механизмов мобилизации и миграции лейкоцитов привело к открытию большого количества потенциальных мишеней для лечения и контроля воспаления. Вещества, блокирующие TNF (один из основных цитокинов при мобилизации лейкоцитов), являются наиболее эффективными лекарственными средствами, когда-либо разработанными для лечения хронических воспалительных заболеваний. Антагонисты лейкоцитарных интегринов (например, VLA-4), селектинов и хемокинов одобрены для лечения воспалительных заболеваний или находятся в стадии клинических исследований. Предположительно эти антагонисты смогут не только эффективно контролировать воспаление, но и нарушать у пролеченных больных защитные антимикробные механизмы — физиологическую функцию воспалительного ответа.
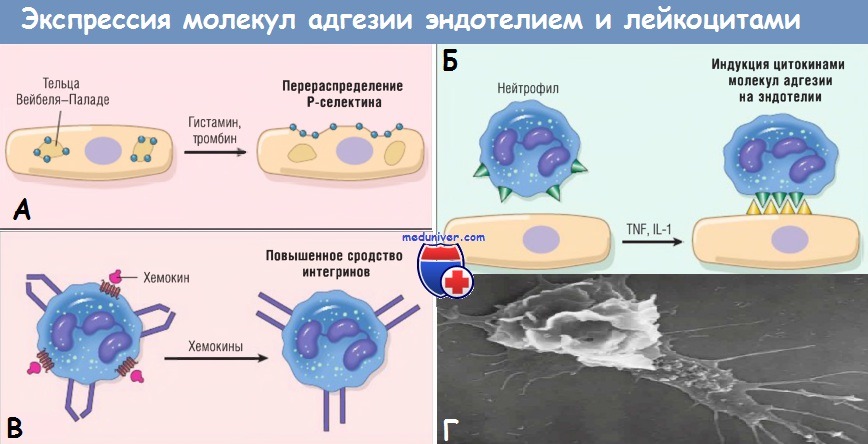
(А) Перераспределение Р-селектина из внутриклеточных запасов на поверхность клетки.
(Б) Повышенная экспрессия на поверхности клетки селектинов и лигандов к интегринам при цитокиновой активации эндотелия.
(В) Повышение сродства интегринов, индуцированное хемокинами. Кластеризация интегринов участвует в повышении их сродства (не показано).
IL — интерлейкин; TNF — фактор некроза опухоли.
(Г) На электронограмме двигающегося лейкоцита в клеточной культуре видны его филоподии (снизу справа) и тянущийся хвост.
- Рекомендуем ознакомиться со следующей статьей "Рецепторы лейкоцитов для выявления микробов и поврежденных тканей"
Оглавление темы "Патофизиология":- Механизмы накопления пигментов в клетке
- Дистрофическая кальцификация аорты как патологическая
- Причины, механизмы метастатической кальцификации тканей и органов
- Механизмы старения клетки и ее этапы
- Определение воспаления и его характеристика
- История изучения воспаления
- Причины острого воспаления
- Изменения сосудов в очаге воспаления: образование транссудата и экссудата
- Реакция лейкоцитов на воспаление - миграция и накопление
- Рецепторы лейкоцитов для выявления микробов и поврежденных тканей

