Механизмы клонирования опухолевых клеток
Для осуществления непрерывного роста и поддержания гомеостаза многих тканей, содержащих короткоживущие клетки (например, клетки крови, эпителия ЖКТ и кожи) необходимо наличие резидентной популяции тканевых стволовых клеток, которые являются долгоживущими и способными к самообновлению.
В тканях эти стволовые клетки выявляются редко, их обнаруживают в нишах, образованных так называемыми поддерживающими клетками, которые продуцируют паракринные факторы, обеспечивающие жизнедеятельность стволовых клеток.
Тканевые стволовые клетки делятся асимметрично, в результате образуются два типа дочерних клеток: с ограниченным пролиферативным потенциалом (они достигают окончательной дифференцировки и погибают) и сохраняющие свойства стволовых клеток.
Злокачественные опухоли бессмертны. Их клетки не имеют лимита пролиферации. Следовательно, злокачественные новообразования, как и нормальные ткани, должны содержать клетки со свойствами «стволовости».
Концепция злокачественных опухолевых стволовых клеток имеет большое значение в связи с несколькими аспектами. Наиболее значимый заключается в следующем: если злокачественные опухолевые стволовые клетки нужны для персистирования опухоли, то для излечения больного, пораженного опухолью, их необходимо уничтожить.
Выдвигается гипотеза, что злокачественные опухолевые стволовые клетки, как и нормальные стволовые клетки, обладают высокой внутренней устойчивостью по отношению к обычной терапии, поскольку имеют низкий уровень пролиферативной активности, а также экспрессируют гены, например ген поливалентной лекарственной устойчивости 1 (MDR1), который противодействует лекарственным химиопрепаратам.
Ограниченный успех современных методов терапии отчасти может быть объяснен неспособностью уничтожить опухолевые стволовые клетки, которые и являются источником развития злокачественной опухоли. Злокачественные опухолевые стволовые клетки могут происходить из тканевых стволовых клеток или из более дифференцированных клеток, которые в процессе злокачественной трансформации приобрели способность самообновления. Исследования больных лейкемией подтвердили оба варианта происхождения этих клеток.
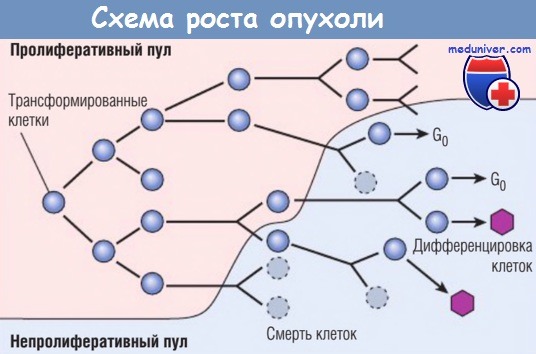
По мере роста популяции опухолевых клеток все большее их количество покидает делящийся пул,
переходит в непролиферативную фазу клеточного цикла (G0) и дифференцируется, другие погибают.
Например, хроническая миелоидная лейкемия развивается из трансформированных нормальных кроветворных стволовых клеток, в то время как определенные формы острой миелоидной лейкемии происходят из более дифференцированной миелоидной клетки-предшественника, преобретшей способность к самообновлению. Определение «лейкемиче-ские стволовые клетки» побудило исследователей к поискам злокачественных опухолевых стволовых клеток в солидных опухолях.
В большинстве таких исследований акцент был сделан на идентификации опухоль-инициирующих клеток — клеток, поддерживающих рост опухоли и обеспечивающих ее идентичность при трансплантации иммунодефицитным мышам. Опухоль-инициирующие клетки найдены в нескольких опухолях человека, включая карциному молочной железы, мультиформную глиобластому, рак толстой кишки и острую миелоидную лейкемию, в которых они составляют от 0,1 до 2% опухолевых клеток. В некоторых злокачественных новообразованиях опухоль-инициирующие клетки встречаются часто и составляют до 25% опухолевых клеток.
Таким образом, одни опухоли могут иметь небольшое количество опухоль-инициирующих клеток, которые подвергаются дифференцировке и образуют опухоль, в то время как другие опухоли могут в основном состоять из опухоль-инициирующих клеток.
В будущем важно идентифицировать онкогенный клон опухолевых клеток в каждой опухоли, чтобы направить терапию против опухолевых стволовых клеток. Остается неясным, являются ли гены и сигнальные пути, поддерживающие жизнедеятельность злокачественных опухолевых стволовых клеток, теми же, что регулируют гомеостаз нормальных тканевых стволовых клеток.
Например, BMI1, компонент комплекса, ремоделирующего хроматин, инициирует «стволовость» как в нормальных кроветворных клетках, так и в лейкемических стволовых клетках, а сигнальный путь WNT, являющийся ключевым регуляторным путем нормальных стволовых клеток кишечных крипт, также вовлечен в поддержание опухолевых стволовых клеток кишечной аденокарциномы. Важнейшие вопросы, оставшиеся без ответов, концентрируются вокруг следующих проблем. Являются ли опухоль-инициирующие клетки точными копиями злокачественных опухолевых стволовых клеток? Остается ли у злокачественных опухолевых стволовых клеток зависимость от ниши, которая поддерживает нормальные стволовые клетки?
Возможно ли селективно и прицельно воздействовать на факторы «стволовости» злокачественных опухолевых стволовых клеток?
- Рекомендуем ознакомиться со следующей статьей "Механизмы местной инвазии опухоли"
Оглавление темы "Патофизиология болезней":- Морфология амилоидоза и ее гистология
- Клиника амилоидоза и его проявления
- Что такое неоплазия и каковы ее причины?
- Что такое доброкачественная опухоль?
- Что такое злокачественная опухоль?
- Что такое степень дифференцировки опухоли и анаплазия?
- Что такое метаплазия и дисплазия?
- Какова скорость роста рака (опухоли)?
- Механизмы клонирования опухолевых клеток
- Механизмы местной инвазии опухоли

