Как бактерии вызывают инфекцию?
а) Вирулентность бактерий. Повреждение организма бактериями зависит от их способности проникать в клетки и ткани или продуцировать токсины. Патогенные бактерии имеют гены вирулентности, которые кодируют белки и определяют их патогенность. Гены вирулентности часто сгруппированны в кластеры, называемые островками патогенности. Все штаммы Salmonella spp., патогенные для человека, достаточно тесно связаны генетически, но при этом могут иметь небольшие различия в содержании генов.
Эти различия и определяют, приведет ли инфицирование сальмонеллами к жизнеугрожающему брюшному тифу или вызовет энтерит, при котором, как правило, не нужно серьезное лечение.
Плазмиды и бактериофаги — подвижные генетические элементы, которые распространяются среди бактерий и могут кодировать факторы вирулентности (например, токсины или ферменты, обеспечивающие устойчивость бактерий к антибиотикам). Таким образом, плазмиды и бактериофаги способны превращать непатогенные бактерии в вирулентные. Обмен этими элементами между бактериями может повысить их выживаемость и/или передать способность вызывать заболевания. Плазмиды и транспозоны, отвечающие за резистентность к антибиотикам, могут превращать антибиотиковосприимчивую бактерию в резистентную, что значительно усложняет процесс лечения (например, появление эндемичных во многих больницах ванкомицин-резистентного энтерококка и метициллин-резистентного стафилококка).
Многие бактерии регулируют экспрессию генов в соответствии с размером своей популяции с помощью так называемого коллективного чувства. Например, бактерии способны индуцировать экспрессию факторов вирулентности при повышении концентрации в тканях. Это позволяет бактериям, растущим в ограниченных полостях, например при абсцессах или организующейся пневмонии, преодолеть защиту организма. S. aureus регулирует факторы вирулентности с помощью секреции аутоиндуцирующих пептидов.
При повышении концентрации бактерий уровень аутоиндуцирующих пептидов также увеличивается, стимулируя продукцию токсинов. В пределах популяции некоторые бактерии продуцируют аутоиндуцирующий пептид, а другие бактерии реагируют на это секрецией токсинов. Таким образом, благодаря коллективному чувству одноклеточные бактерии приобретают некоторые свойства сложных многоклеточных организмов, в которых различные клетки выполняют разные функции.
Сообщества бактерий могут формировать биопленки, в которых микроорганизмы живут в вязком слое внеклеточных полисахаридов, которые покрывают ткани организма или устройства, например внутрисосудистые катетеры или искусственные суставы. Биопленки увеличивают вирулентность бактерий, делая их недоступными для иммунных агентов и повышая резистентность к противомикробным препаратам. Формирование биопленок играет важную роль в персистировании и рецидивах таких заболеваний, как бактериальный эндокардит, инфекции искусственных суставов и дыхательных путей у пациентов с кистозным фиброзом.
б) Адгезия бактерий к клеткам организма-хозяина. Адгезины — поверхностные бактериальные молекулы, которые связываются с клетками или ВКМ. Адгезины ограниченны в структурном типе, но имеют широкий диапазон клеточной специфичности. S. pyogenes — грамположительная бактерия, которая адгезирует к тканям организма-хозяина посредством F-белка и тейхоевых кислот, выступающих на поверхности клеточной стенки бактерий и связывающихся с фибронектином на поверхности клетки организма-хозяина и в ВКМ.
Пили — это филаментные белки на поверхности бактерий. Стебли пилей состоят из консервативных повторяющихся субъединиц белка, в то время как аминокислоты на окончаниях представляют собой изменяющиеся структуры, которые и определяют специфику связывания. Например, штаммы Е. coli, вызывающие инфекции мочевыводящих путей, экспрессируют пили типа Р, которые связываются с gal(al-4)gal-мотивом углевода, присутствующим на уротелии. Пили N. gonorrhoeae содействуют прикреплению бактерий к клеткам организма-хозяина и могут также играть роль мишени при формировании антител; последующее изменение пилей — важный механизм, с помощью которого N. gonorrhoeae избегают иммунного ответа.
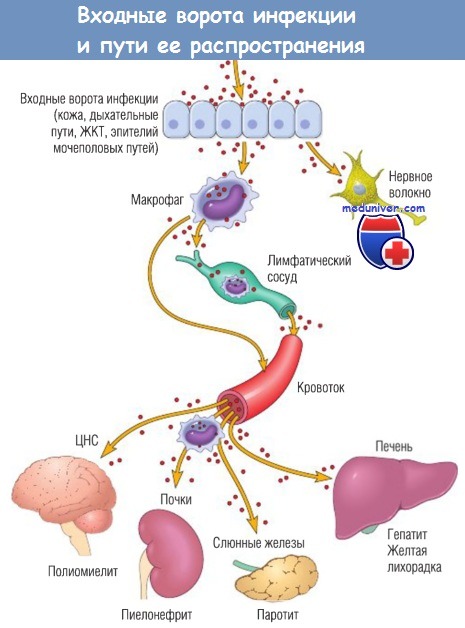
Для проникновения в организм-хозяин патогены разрушают эпителиальный или слизистый барьер.
Инфекция может локализоваться в месте входа возбудителя или распространиться по всему организму-хозяину.
Большинство микроорганизмов перемещаются по лимфатической системе или с кровотоком (свободно или в пределах клеток воспаления). Однако определенные вирусы и бактериальные токсины могут распространяться по нервным волокнам.
ЖКТ — желудочно-кишечный тракт; ЦНС — центральная нервная система.
в) Вирулентность внутриклеточных бактерий. Факультативные внутриклеточные бактерии заражают эпителиальные клетки (Shigella spp., энтероинвазивные штаммы Е. coli), макрофаги (М. tuberculosis, М. leprae) или оба типа клеток (S. typhi). Внутриклеточный рост — способ, не только позволяющий избежать действия определенных эффекторных иммунных механизмов (например, антител), но также облегчающий распространение бактерий в пределах организма-хозяина (например, М. tuberculosis разносятся из легких в другие органы мигрирующими макрофагами).
Бактерии имеют несколько механизмов для проникновения в клетки организма-хозяина. Некоторые бактерии используют иммунный ответ для попадания внутрь макрофагов. Покрытие бактерии антителами или белком С3b системы комплемента (опсонизация) в норме обеспечивает фагоцитоз возбудителя макрофагами. Однако, подобно многим бактериям, М. tuberculosis после опсонизации СЗb активируют систему комплемента по альтернативному пути и связываются с СR3-рецептором на макрофагах, в результате происходит эндоцитоз микроорганизма в клетку. Грамотрицательные бактерии используют сложную секреторную систему для проникновения в эпителиальные клетки. На поверхности клетки бактерии присутствуют иглоподобные структуры, которые связываются с клетками организма-хозяина.
Через поры в клеточной мембране бактерии вводят в клетку белки, обеспечивающие перестройку ее цитоскелета, что облегчает проникновение бактерий. Такие бактерии, как L. monocytogenes, могут управлять цитоскелетом клетки для распространения инфекции непосредственно от клетки к клетке, что, возможно, также позволяет им уклониться от иммунного ответа.
Оказавшись в цитоплазме, бактерия осуществляет различные взаимодействия с клеткой. Shigella spp. и E. coli ингибируют синтез белка в клетке, быстро размножаются и лизируют клетку организма-хозяина в течение 6 час. В макрофагах после слияния фагосомы и лизосомы в фаголизосому уничтожается большинство бактерий, но некоторым из них удается избежать этого защитного механизма. Например, М. tuberculosis блокирует слияние лизосомы с фагосомой, что позволяет этой бактерии бесконтрольно пролиферировать внутри макрофага. Другие бактерии избегают разрушения в макрофагах, выходя из фагосом. L. monocytogenes вырабатывает формирующий пору белок, называемый листериолизином О, и две фосфолипазы, которые повреждают мембрану фагосомы и позволяют бактерии спастись.
г) Бактериальные токсины. Любое вещество бактерии, способное вызывать повреждение, называют токсином. Токсины разделяют на два вида: эндотоксины, которые являются компонентами клеточной стенки, и экзотоксины, представляющие собой белки, секретируемые клеткой бактерий.
Бактериальный эндотоксин — липополисахарид — главный компонент наружной стенки клетки грамотрицательных бактерий. Липополисахарид имеет так называемый якорь, состоящий из длинной цепи жирной кислоты (липид А), и связанную с ним основную сахарную цепь — компоненты, аналогичные для всех грамотрицательных бактерий. Прикрепленную к основному сахару переменную цепь углевода (О-антиген) можно использовать для штаммов бактерий. Ответ организма-хозяина на липополисахариды может быть и полезным, и вредным. Низкий уровень липополисахаридов стимулирует образование многих важных цитокинов и хемокинов, а также увеличение экспрессии костимулирующих молекул, мобилизующих лейкоциты и повышающих активацию Т-лимфоцитов.
Высокие уровни липополисахаридов играют важную роль в развитии септического шока, ДВС-синдрома и респираторного дистресс-синдрома взрослых, главным образом через индукцию чрезмерных уровней цитокинов, таких как TNF, IL-1, IL-12. Липополисахарид связывается с поверхностным клеточным рецептором CD14, затем этот комплекс связывается с TLR4, который является рецептором врожденной иммунной системы, и вызывает клеточный иммунный ответ.
Экзотоксины — белки, непосредственно повреждающие клетки и часто лежащие в основе проявлений болезни. Экзотоксины можно разделить на группы на основе их расположения и механизма действия (подробно описаны в разделах, посвященных каждому отдельному типу бактерий):
- ферменты. Бактерии вырабатывают различные ферменты (протеазы, гиалуронидазы, коагулазы, фибринолизины), которые действуют на соответствующие субстраты in vitro, однако роль некоторых из ферментов в развитии заболеваний до сих пор не ясна. Например, определенные протеазы, продуцируемые S. aureus, разрушают белки, связывающие кератиноциты, вызывая отделение эпидермиса от подлежащих слоев кожи;
- токсины. Изменяют внутриклеточную передачу сигналов и регуляторные пути. Многие токсины имеют субъединицу с ферментной активностью (А-субъединицу) и субъединицу, которая связывается с рецептором на поверхности клетки и обеспечивает проникновение А-субъединицы в цитоплазму (В-субъединицу). Эффекты токсинов зависят от специфичности связывания В-домена и от вида клеточного пути, пораженного А-доменом. Токсины с А- и В-субъединицами имеют многие бактерии, включая В. anthracis, V. cholerae, и некоторые штаммы Е. coli.
- нейротоксины. Их продуцируют С. botulinum и С. tetani, что подавляет выброс нейромедиаторов и приводит к параличам. Эти токсины нейроны не повреждают, вместо этого А-субъединицы специфически взаимодействуют с белками, вовлеченными в синтез нейромедиаторов в синапсах. И столбняк, и ботулизм приводят к летальному исходу от остановки дыхания, возникающей вследствие паралича диафрагмы и мышц грудной клетки;
- суперантигены. Эти бактериальные токсины обусловливают появление огромного количества Т-лимфоцитов. Суперантигены связываются со стабильной частью рецептора Т-клеток, что вызывает массивную пролиферацию Т-лимфоцитов и выброс цитокинов. Высокие уровни цитокинов могут привести к спадению капилляров и шоку. Суперантигены, продуцируемые S. aureus и S. pyogenes, ассоциируются с синдромом токсического шока.
- Рекомендуем ознакомиться со следующей статьей "Механизмы повреждения тканей иммунитетом"
Оглавление темы "Патофизиология инфекционных болезней":- Средства биотерроризма и биологического оружия
- Виды входных ворот инфекций
- Пути распространения инфекции в организме
- Пути выхода инфекции из организма хозяина
- Виды инфекций передающихся половым путем (ИППП)
- Механизмы защиты организма от инфекций
- Как вирусы вызывают инфекцию?
- Как бактерии вызывают инфекцию?
- Механизмы повреждения тканей иммунитетом
- Механизмы защиты вирусов, бактерий от иммунитета

