Обработка вирусных срезов для гибридизации. Зонды для выявления вирусов
Во избежание артефактов и появления фона, особенно при работе с радиоактивно меченными зондами, важно депарафинировать срез полностью.
Кислотный гидролиз. По данным некоторых авторов, обработка срезов 0,2 М соляной кислотой в течение 20 мин усиливает гибридизационный сигнал. При такой обработке из тканей удаляются белки, что увеличивает их проницаемость для зондов. Впрочем, по нашим данным, при выявлении генетического материала вирусов кислотный гидролиз, напротив, приводит к ослаблению гибридизационного сигнала. Возможно, это связано с тем, что при кислотной обработке происходит апуринизация ДНК и это ухудшает гибридизацию.
Протеолиз. Обработка срезов протеолитическими ферментами — очень ответственный этап. Если протеолиз недостаточно продолжителен, то зонд не может проникнуть внутрь клетки и достичь мишени, а если слишком длительный, то происходят серьезные нарушения структуры клеток и интерпретация результатов становится невозможной или из ткани вымываются нуклеиновые кислоты-мишени, а сами клетки теряют адгезивные свойства и отлипают от стекла. Важное значение имеет качество протеолитического фермента: если в ферментном препарате присутствуют нуклеазы, то может произойти разрушение ДНК-мишени. Чтобы предотвратить это, в инкубационную смесь добавляют 5 мМ ЭДТА, ингибирующий магнийзависимые нуклеазы. Мы предпочитаем использовать протеиназу К (Boehringer Mannheim). Оптимальное время протеолиза зависит от типа зонда, ткани и режима фиксации. Например, для излишне фиксированных тканей (обработанных концентрированным раствором формалина или фиксированных слишком долго) необходим более длительный протеолиз. Режим протеолиза в каждой лаборатории следует подбирать опытным путем.
Некоторые авторы указывают на целесообразность дополнительной фиксации параформальдегидом для усиления гибридизационного сигнала, полагая, что при протеолизе ДНК-мишень может выходить из внутриклеточного матрикса и экстрагироваться в ходе гибридизации или удаляться со стекла во время многочисленных последующих промываний препаратов, а обработка параформальдегидом способствует мягкой фиксации этих последовательностей в ткани. Однако, проводя гибридизацию in situ для выявления вирусных генов, мы не заметили никакого положительного эффекта от дополнительной фиксации, что противоречит данным других авторов.
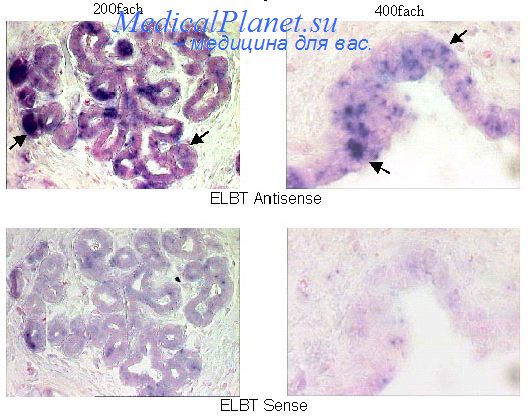
Ацетилирование. Иногда для уменьшения фонового окрашивания проводят ацетилирование — наиболее эффективный способ снижения неспецифического связывания отрицательно заряженных зондов. Ацетилирование необходимо прежде всего при работе с радиоактивными зондами. Используя S-зонд, полученный с помощью ник-трансляции, и проводя радиоавтографию в течение 4—6 сут, мы обходились без ацетилирования. Однако при более длительной экспозиции или слишком сильном неспецифическом связывании (высоком фоне) эта процедура необходима.
Зонды для выявления вирусов
Имеются три основные типа зондов:
а) фрагменты комплементарной ДНК (кДНК), входящие в состав плазмидного вектора или изолированные;
б) комплементарная РНК(кРНК), встроенная в плазмидный вектор, который содержит сайт инициации транскрипции, распознаваемый бактериальной РНК-полимеразой (обычно SP6);
в) синтетические некодируюшие олигонуклеотиды, полученные с помощью автоматического ДНК-синтезатора.
Для гибридизации in situ широко используются двухцепочечные зонды и высокоспецифичные термостабильные РНК-зонды. Синтетические олигонуклеотиды обладают рядом преимуществ перед кДНК: а) для них характерна постоянная и высокоспецифическая активность; б) их можно синтезировать исходя из данных о соответствующей аминокислотной последовательности, не зная последовательности ДНК; в) есть возможность получать нуклеотидные последовательности, комплементарные данному гену. Однако у них есть и недостатки: стабильность этих зондов мало изучена; не разработаны оптимальные условия гибридизации; если по каким-либо причинам в данные о нуклеотидной последовательности вкралась ошибка (например, типографского характера), могут быть получены неправильные результаты.
- Читать далее "Мечение зондов для гибридизации вирусов. ДНК-зонды для выявления вирусов"
Оглавление темы "Выявление вирусов при гибридизации in situ":1. Контроли при гибридизации in situ. Виды контролей при гибридизации in situ
2. Высокий фон при гибридизации in situ. Оборудование для гибридизации in situ
3. Реактивы для гибридизации in situ. Гибридизация in situ и гистологическое окрашивание
4. Комбинирование иммуноцитохимии и гибридизации in situ. Многократная гибридизация in situ
5. Выявление вирусов методом гибридизации in situ. Подготовка предметных стекол для выявления вирусов
6. Препараты приготовленные с помощью центрифугирования. Биоптаты для выявления вирусов
7. Обработка вирусных срезов для гибридизации. Зонды для выявления вирусов
8. Мечение зондов для гибридизации вирусов. ДНК-зонды для выявления вирусов
9. РНК-зонды для выявления вирусов. Олигонуклеотидные зонды для диагностики вирусов
10. ПНР-зонды для выявления вирусов. Получение ДНК-зондов для выявления вируса папилломы человека

