Гуморальный иммунитет и структура антител
- Гуморальный иммунитет опосредуется антителами, вырабатываемыми В-лимфоцитами, и является формой специфического иммунитета, направленного в первую очередь против внеклеточных антигенов.
- Молекулы антитела состоят из двух идентичных легких цепей, ковалентно связанных с двумя идентичными тяжелыми цепями. Вариабельный участок молекулы антигена отвечает за связывание антитела, а стабильный участок опосредует большинство эффекторных функций.
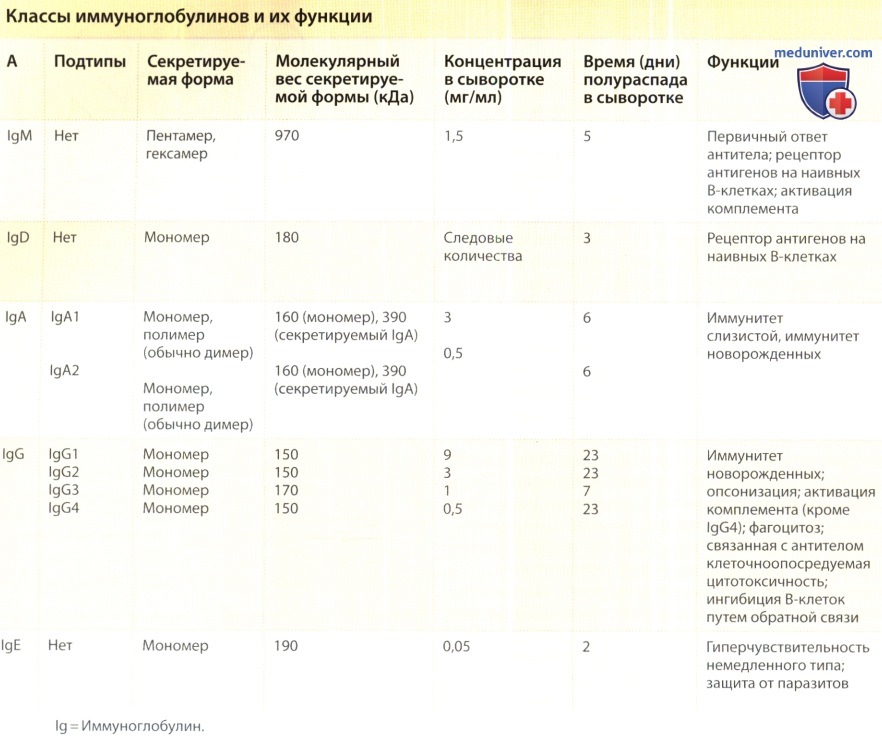
- Антитела подразделяются на пять классов, каждый из которых отвечает за выполнение определенных функций. Иммуноглобулин М (IgM) участвует в первичном ответе антител; иммуноглобулин D (IgD) является рецептором антигенов на наивных В-клетках; иммуноглобулин A (IgA) играет решающую роль в иммунитете слизистых оболочек. Иммуноглобулин G (IgG) — основной иммуноглобулин в кровообращении — крайне важен во вторичном ответе антител, а иммуноглобулин Е (IgE) опосредует иммунитет к паразитам.
- Благодаря процессам рекомбинации генов и разнообразию соединений индивидуум способен производить миллионы различных антител в миллионах отличных друг от друга В-клеточных клонов.
а) В-лимфоциты. В процессе эволюции у челюстных позвоночных выработалось исключительное разнообразие реакций на вторжение чужеродных организмов. Специфический иммунитет определяется, во-первых, множеством возможных иммунных ответов и, во-вторых, их усовершенствованием при последующих воздействиях на организм. Клетками, осуществляющими дифференцировку благодаря обширному репертуару своих рецепторов, являются лимфоциты.
Специфический иммунитет называют также адаптивным иммунитетом, т.к. он развивается в результате адаптации к инфекции. Адаптивный иммунитет подразделяется на гуморальный иммунитет (опосредуется антителами, вырабатываемыми В-лимфоцитами) и клеточный иммунитет (опосредуется Т-лимфоцитами). Каждая из этих разновидностей специфического иммунитета отвечает за выполнение определенной функции. Гуморальный иммунитет в первую очередь противостоит внеклеточным антигенам, таким как циркулирующие бактерии и токсины.
Клеточный иммунитет направлен главным образом против антигенов, которые инфицируют или населяют клетки. Для борьбы с внеклеточными патогенами требуется, чтобы защитный агент был в большом количестве рассредоточен по всему организму; в особенности необходим он в местах прямого контакта с окружающей средой. Подобным требованиям удовлетворяют антитела: они могут быть в обилии секретированы производящими их клетками и распределяются в кровь, слизистые оболочки и интерстициальную жидкость.
Кроме того, с помощью своих Fc-рецепторов (FcRs) антитела способны прикрепляться к поверхности некоторых других клеток иммунной системы (например, тучных клеток), придавая антигенную специфичность тем клеткам, которые не имеют собственных эндогенных антигенспецифических рецепторов. Помимо своей основной функции выработки антител в рамках гуморального иммунитета, В-лимфоциты играют роль в презентации антигенов, регуляции популяции Т-клеток и дендритных клеток, организации лимфоидных тканей и продукции цитокинов и хемокинов.
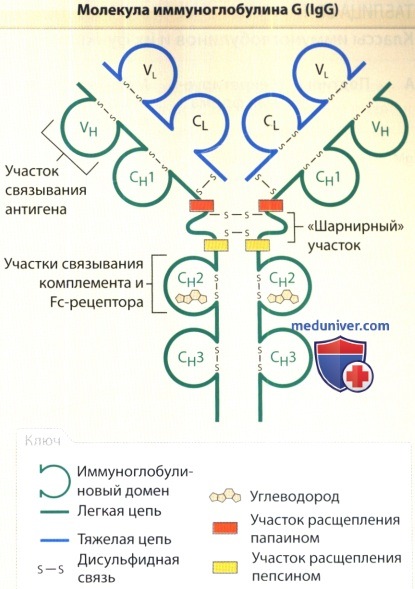
б) Структура антител. Антитела или иммуноглобулины (Ig) представляют собой род гликопротеинов, обладающих общностью структуры. Молекула антитела имеет симметричную Y-образную форму и состоит из двух идентичных легких цепей (около 24 кДа), ковалентно связанных с двумя идентичными тяжелыми цепями (масса каждой около 55 или 70 кДа), которые, в свою очередь, ковалентно связаны друг с другом. В пределах легких и тяжелых цепей имеются вариабельные и константные участки.
Основной функцией вариабельного участка является распознавание антигена, в то время как константный участок отвечает за эффекторные функции. Легкие и тяжелые цепи содержат серию повторяющихся гомологических единиц, состоящих примерно из 110 аминокислот. Подобные элементы имеют сферическую структуру и называются иммуноглобулиновыми доменами (Ig-domains). Мотив иммуноглобулинового домена встречается не только в молекулах антител, но и в ряде других молекул «суперсемейства» иммуноглобулинов, среди которых Т-клеточный рецептор, главный комплекс гистосовместимости (ГКГ), CD4, CD8, молекула межклеточной адгезии 1 и др.
Легкая цепь содержит два главных домена: (1) вариабельный (VL) и (2) константный (CL). Тяжелые цепи имеют четыре или пять доменов: один вариабельный (VH) и три (IgA, IgD и IgG) или четыре (IgM и IgE) константных (СH1-4). У IgA, IgG и IgD существует «шарнирный» участок между СH1 и СH2, придающий молекуле дополнительную гибкость. Вариабельные домены находятся в N-конце полипептидной цепи. На С-конце цепи расположены константные домены, а также в тяжелых цепях мембраносвязанных антител трансмембранные и цитоплазматические домены.
В составе вариабельных участков легких и тяжелых цепей существуют три зоны интенсивной изменчивости, называемые гипервариабельными участками — в трехмерной структуре антитела они располагаются неподалеку друг от друга. Данные участки имеют принципиальное значение для связывания антигена. Они принимают форму, дополнительную (комплементарную) по отношению к антигену, и в связи с этим называются также участками, определяющими комплементарность. У человека количество образуемых гипервариабельными участками областей антител недостаточно для возникновения аутотолерантности.
По этой причине иммунная система может производить антитела к указанным областям, не распознав, что такой редко встречающийся фрагмент антитела является родным. Область антитела, способная генерировать иммунный ответ, называется идиотопом. Ответы антител на идиотопы приводят к перекрестным взаимодействиям идиотопов и анти-идиотопов, что помогает регулировать гуморальный иммунный ответ.
Существует два типа легких цепей: κ и λ. Каждая молекула антитела имеет в своем составе либо две κ-цепи, либо две λ-цепи; сочетание двух различных цепей в одной молекуле невозможно. Функциональные различия (если таковые имеются) между κ- и λ-цепями пока не установлены. Тяжелые цепи представлены пятью типами: (1) α, (2) δ, (3) ε, (4) γ и (5) μ-соотносящимися соответственно с пятью классами антител: IgA, IgD, IgE, IgG и IgM.
Различные классы тяжелых цепей выполняют разные функции. Классы IgA и IgG подразделяются на близкородственные подклассы: подклассами IgA являются IgA1 и IgA2, подклассами IgG — IgG1, IgG2, IgG3 и IgG4.
В результате ферментного расщепления молекул IgG под действием папаина образуются три продукта: два идентичных Fab-фрагмента, состоящих из легкой цепи, которая связана с участком V-CH-1 тяжелой цепи, и фрагмент Fc, представленный двумя тяжелыми цепями СH2-СH3, связанными друг с другом. Название фрагмента Fab представляет собой аббревиатуру, образованную от «Fragment antigen binding» (англ.) — «фрагмент, связывающий антиген»; фрагмент Fc (сокр. от англ. Fragment crystallizable region) назван так из-за своей способности к кристаллизации.
Разложение IgG пепсином приводит к тому, что С-концевой участок полипептидной цепи распадается на небольшие фрагменты. Оставшийся продукт состоит из Fab-фрагмента с «шарнирным» участком. Обозначением Fab-фрагмента, содержащего «шарнирный» участок, является Fabr. Если два Fabr-фрагмента остаются связанными в молекуле антитела, подобный фрагмент обозначается как F (abr).
- Рекомендуем далее ознакомиться со статьей "Виды иммуноглобулинов и их функции"
Оглавление темы "Гуморальный иммунитет и антитела при болезнях кожи.":
