Механизмы иммунодефицита при ВИЧ-инфекции
Потеря Т-клеток CD4+ в основном обусловлена инфицированием клеток и прямым цитопатическим эффектом реплицирующегося вируса. Каждый день образуется 10 млрд новых вирусных частиц и погибает 1-2 млрд Т-клеток CD4+. Поскольку число инфицированных клеток в крови очень мало, длительное время подозревали, что иммунодефицит несоразмерен уровню инфекции и его невозможно объяснить смертью инфицированных клеток.
Действительно, многие инфицированные клетки могут находиться в лимфоидной ткани слизистых оболочек и других периферических лимфоидных органов. Смерть этих клеток служит главной причиной непрекращающейся и часто существенной потери клеток.
Кроме того, до определенного момента иммунная система может заменять гибнущие Т-клетки, поэтому скорость потери Т-клеток обманчиво низка. Однако по мере прогрессирования заболевания обновление Т-клеток CD4+ уже не способно восполнять их потерю. Возможным механизмом прямого фатального действия вируса на инфицированные клетки может быть повышение проницаемости плазматической мембраны, связанное с отпочковыванием частиц вируса от инфицированных клеток, и репликация вируса, интерферирующая синтез белков.
В дополнение к прямому киллингу клетки вирусом потере Т-клеток могут способствовать и другие механизмы:
- ВИЧ колонизирует лимфоидные органы (селезенку, лимфоузлы, миндалины) и может вызвать прогрессирующее разрушение структуры и клеточного состава лимфоидной ткани;
- постоянная активация неинфицированных клеток, отвечающих на ВИЧ или инфекции, обычно возникающие при СПИДе, приводит к смерти клеток, индуцированной активацией (апоптозу). Таким образом, количество погибающих Т-клеток CD4+ становится значительно больше количества инфицированных клеток. Молекулярные механизмы смерти клеток этого типа неизвестны;
- потеря незрелых предшественников Т-клеток CD4+ в результате либо прямой инфекции тимусных клеток-предшественников, либо инфекции А-клеток, секретирующих цитокины, имеющие значение для созревания Т-клеток CD4+;
- слияние инфицированных и неинфицированных клеток с образованием синцития (гигантских клеток). В культуре ткани белок gp120, экспрессированный инфицированными клетками, связывается с CD4-молекулами на неинфицированных Т-клетках, затем клетки сливаются, увеличиваются в размерах и обычно погибают в течение нескольких часов. Свойством индуцировать образование синцития обычно обладает лишь Т-тропный тип Х4 ВИЧ-1, поэтому данный тип вируса часто называют индуцирующим синцитий вирусом в отличие от вируса R5;
- апоптоз неинфицированных Т-клеток CD4+ при связывании растворимого gp120 с CD4-молекулами и последующей активации антигенами через TCR. Высказано предположение, что такое перекрестное связывание CD4-молекул и активация Т-клеток обусловливают неадекватную сигнализацию и активацию путей, приводящих к смерти клеток. Цитотоксические Т-лимфоциты CD8+ способны уничтожать неинфицированные Т-клетки CD4+, покрытые gp120, высвободившимся из инфицированных клеток.
Хотя заметное снижение числа Т-клеток CD4+ (отличительный признак СПИДа) дает возможность объяснить большинство проявлений иммунодефицита на поздних стадиях заболевания, существуют убедительные доказательства присутствия качественных дефектов Т-клеток даже у лиц с бессимптомной ВИЧ-инфекцией, в частности снижение индуцированной антигеном пролиферации Т-клеток, ослабление ответа Тh1 -клеток по сравнению с ответом Тh2-клеток, нарушения внутриклеточной сигнализации и многие другие. Ослабление ответа Тh1 -клеток приводит к глубокому дефициту клеточного иммунитета и повышению восприимчивости к вирусным инфекциям, а также другим внутриклеточным микробам.
Кроме того, избирательно уменьшается число хелперных Т-клеток памяти CD4+ на ранних стадиях болезни, что обусловливает слабый вторичный ответ на ранее введенный антиген.
Хроническая инфекция, протекающая на низком уровне, или латентная инфекция Т-клеток (и макрофагов) — важный признак ВИЧ-инфекции. Широко распространено мнение, что интегрированный провирус в отсутствие экспрессии вируса (латентная инфекция) способен сохраняться в клетках в течение нескольких месяцев или лет. Даже высокоэффективная антивирусная терапия, практически стерилизующая кровь, не элиминирует латентный вирус, «спрятавшийся» в клетках CD4+ (и в Т-клетках, и в макрофагах) лимфоузлов. По некоторым расчетам, 0,05% покоящихся Т-клеток CD4+ в лимфоузлах являются латентно инфицированными. Поскольку эти клетки представляют собой Т-клетки памяти, они сохраняются на месяцы и годы и служат персистирующим резервуаром вируса.
Т-клеткам CD4+ принадлежит ведущая роль в регуляции клеточного и гуморального иммунных ответов, поэтому утрата «главного регулятора» оказывает неблагоприятное влияние практически на любой другой компонент иммунного ответа.
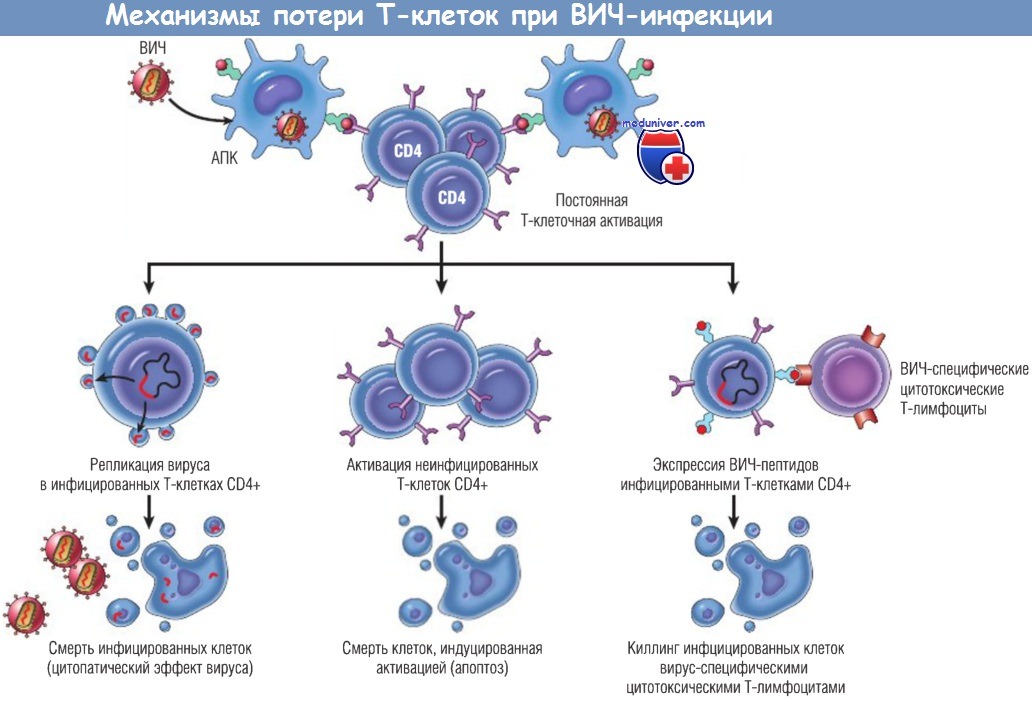
Показаны некоторые механизмы смерти Т-клеток после заражения ВИЧ.
АПК — антигенпрезентирующая клетка; ВИЧ — вирус иммунодефицита человека.
Помимо инфицирования и уменьшения численности Т-клеток CD4+ инфекция макрофагов и дендритных клеток также играет существенную роль в патогенезе ВИЧ-инфекции. Подобно Т-клеткам, большинство макрофагов, инфицированных ВИЧ, обнаруживается в тканях, а число инфицированных вирусом моноцитов крови может быть низким. В некоторых тканях, например легких и головного мозга, инфицированными оказываются от 10 до 50% макрофагов. Следует упомянуть некоторые аспекты ВИЧ-инфекции макрофагов:
- для репликации ретровирусов необходимо клеточное деление, но ВИЧ-1 способен инфицировать окончательно дифференцированные (неделящиеся) макрофаги и размножаться в них. Эта способность ВИЧ-1 зависит от присутствия гена vpr. Белок VPR дает возможность преинтеграционному комплексу ВИЧ проникнуть в ядро через ядерную пору;
- инфицированные макрофаги отпочковывают относительно небольшое количество вируса с клеточной поверхности, однако эти клетки содержат большое количество вирусных частиц, часто находящихся во внутриклеточных вакуолях. Хотя репликация вируса происходит в макрофагах, они высокорезистентны к цитопатическим эффектам ВИЧ в отличие от Т-клеток CD4+. Таким образом, макрофаги могут служить резервуаром инфекции и возбудитель остается надежно защищенным от воздействий со стороны организма. На поздних стадиях ВИЧ-инфекции, когда число Т-клеток CD4+ существенно снижено, макрофаги предоставляют возможность дальнейшей репликации вируса;
- по всей видимости, макрофаги выполняют функцию контролера, регулирующего доступ инфекции к клеткам. Следует вспомнить, что более чем в 90% случаев острая ВИЧ-инфекция характеризуется преобладанием циркулирующих М-тропных штаммов вируса. Эти данные показывают, что инициальная инфекция макрофагов или дендритных клеток может быть важным фактором в патогенезе ВИЧ-инфекции.
Опубликованы данные, что даже у неинфицированных моноцитов существуют необъяснимые функциональные дефекты, которые могут оказать существенное влияние на состояние защиты организма-хозяина. К таким дефектам относятся нарушения микробицидной активности, сниженный хемотаксис, уменьшение секреции IL-1, неадекватная секреция TNF и ослабление способности презентировать антигены Т-клеткам. Кроме того, даже небольшое количество инфицированных моноцитов крови может служить средством транспорта ВИЧ в различные органы, включая нервную систему.
Установлено, что помимо макрофагов мишенями инициации и поддержания ВИЧ-инфекции служат дендритные клетки двух типов: дендритные клетки слизистых оболочек и фолликулярные дендритные клетки. Предполагается, что дендритные клетки слизистых оболочек инфицируются вирусом и переносят его в регионарные лимфоузлы, где вирус передается Т-клеткам CD4+. Дендритные клетки экспрессируют также лектиноподобный рецептор, специфически связывающий ВИЧ и презентирующий его в интактной инфекционной форме Т-клеткам, тем самым способствуя их инфицированию.
Фолликулярные дендритные клетки в герминативных центрах лимфоузлов, подобно макрофагам, служат потенциальным резервуаром ВИЧ. Некоторые из этих клеток могут быть восприимчивыми к ВИЧ-инфекции, но большая часть вирусных частиц обнаруживается на поверхности их древовидных отростков. Фолликулярные дендритные клетки имеют рецепторы для Fc-фрагментов Ig, поэтому способны захватывать вирионы ВИЧ, покрытые антителами анти-ВИЧ. Такие вирионы, локализованные на фолликулярных дендритных клетках, сохраняют способность инфицировать Т-клетки CD4+, т.к. проходят через сложную сеть, образуемую дендритными отростками фолликулярных дендритных клеток.
У больных СПИДом наблюдаются серьезные нарушения функций В-клеток. Как это ни парадоксально, при СПИДе происходит поликлональная активация В-клеток, приводящая к В-клеточной гиперплазии в герминативных центрах (особенно на ранних стадиях заболевания), плазмоцитозу в костном мозге, гипергаммаглобулинемии и образованию циркулирующих иммунных комплексов. Эта активация может быть результатом взаимодействия ряда факторов: реактивации (или реинфекции) CMV и EBV, каждый из которых является поликлональным активатором В-клеток; gp41 сам способен стимулировать рост и дифференцировку В-клеток; ВИЧ-инфицированные макрофаги продуцируют повышенное количество IL-6, также стимулирующего пролиферацию В-клеток.
Несмотря на присутствие спонтанно активированных В-клеток, организм больных СПИДом не способен полноценно продуцировать антитела к новым, посторонним антигенам. Частично это может быть обусловлено отсутствием Т-клеточной помощи, однако подавленным оказывается также иммунный ответ на Т-независимые антигены, что свидетельствует о каких-то внутренних дефектах В-клеток.
Нарушение гуморального иммунитета делает этих пациентов жертвами диссеминированных инфекций, вызываемых капсульными бактериями, например S. pneumoniae и Н. influenzae, для эффективной опсонизации и элиминации которых необходимы антитела.

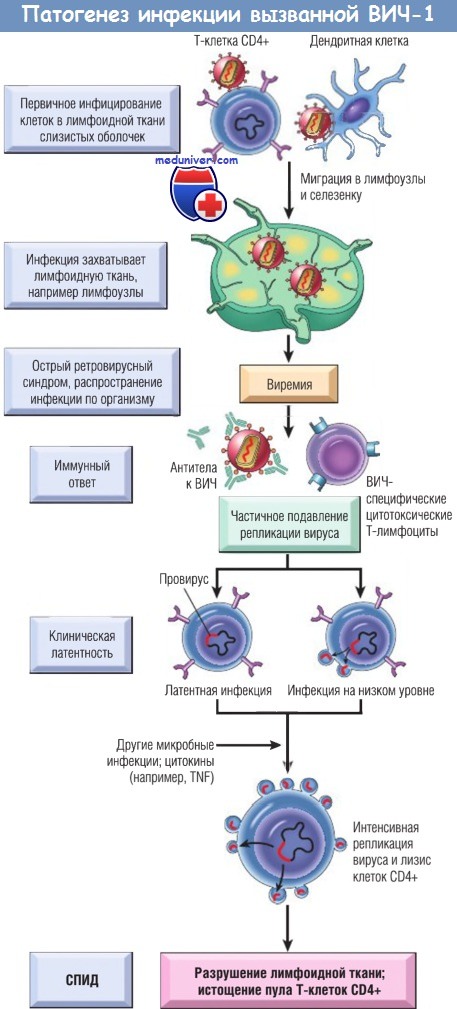
Затем инфекция распространяется в лимфатические узлы. Репликация вируса приводит к виремии, и вирус колонизирует всю лимфоидную ткань.
Виремия ограничивается иммунным ответом организма-хозяина (не показано), и наступает фаза клинической латентности.
Во время этой фазы репликация вируса в Т-клетках и макрофагах идет непрерывно, хотя в какой-то степени сдерживается иммунными механизмами (не показано).
Продолжается постепенное уменьшение числа Т-клеток CD4+, в конце концов оно уменьшается настолько, что у пациента развиваются клинические симптомы СПИДа.
TNF — фактор некроза опухоли; ВИЧ — вирус иммунодефицита человека; СПИД — синдром приобретенного иммунодефицита.
- Вернуться в оглавление раздела "Патофизиология"
Оглавление темы "Заболевания иммунной системы":- Механизмы развития синдрома гипер-IgM
- Механизмы развития синдрома Ди Джорджи (гипоплазии тимуса)
- Механизмы развития тяжелого комбинированного иммунодефицита (ТКИД)
- Механизмы развития иммунодефицита с тромбоцитопенией и экземой (синдрома Вискотта-Олдрича)
- Механизмы развития генетической недостаточности системы комлемента
- Вторичные иммунодефициты и их характеристика
- Распространенность СПИД (ВИЧ) и группы риска
- Свойства ВИЧ и его строение
- Механизмы развития ВИЧ-инфекции - жизненный цикл ВИЧ
- Механизмы иммунодефицита при ВИЧ-инфекции

