Сосудистый фактор роста и рецепторы в регуляции ангиогенеза
Несмотря на разнообразие факторов роста, участвующих в ангиогенезе, VEGF является самым важным фактором роста в тканях взрослого организма при физиологическом ангиогенезе (например, пролиферации эндометрия), а также ангиогенезе, происходящем при хроническом воспалении, заживлении ран, опухолях и диабетической ретинопатии.
Как упоминалось ранее, VEGF продуцируется многими мезенхимальными и стромальными клетками. Из рецепторов VEGF тирозинкиназный рецептор VEGFR-2 является важнейшим в процессе ангиогенеза. Он экспрессируется эндотелиальными клетками и их предшественниками, другими типами клеток и многими опухолевыми клетками.
VEGF (точнее, его циркулирующие изоформы VEGF121 и VEGF165) передает сигнал через VEGFR-2 (также известный как KDR у людей и flk-1 у мышей). В костном мозге VEGF вызывает миграцию эндотелиальных клеток-предшественников и усиливает пролиферацию и дифференцировку этих клеток в местах ангиогенеза. В ангиогенезе из предсуществующих сосудов VEGF стимулирует выживание эндотелиальных клеток, их деление и подвижность, инициируя рост новых капилляров.
Основные компоненты системы VEGF/VEGFR и их эффекты представлены в таблице ниже. Пролиферация, дифференцировка и миграция эндотелиальных клеток также могут стимулироваться фактором FGF-2.
Несмотря на многообразие эффектов VEGF и механизмов регуляции экспрессии, возникает вопрос: как при ангиогенезе из эндотелиальных клеток развивается идеальная модель сосудов? Недавно был определен механизм регуляции васкулогенеза через сигнальный путь Notch, который способствует правильному ветвлению новых сосудов и предотвращает избыточный ангиогенез путем уменьшения чувствительности к VEGF.
Лиганды и рецепторы Notch — мембраносвязанные молекулы, одинаковые для животных. У млекопитающих имеются пять лигандов Notch (Jagged-1 и Jagged-2, D11-1, D11-3 и Dll-4) и четыре трансмембранных рецептора (Notch-1, Notch-2, Notch-3, Notch-4). Внеклеточная поверхность рецепторов содержит EGF-подобные повторы, служащие в качестве лигандсвязывающих участков. D11-4 является специфическим для эндотелиальных клеток и экспрессируется в артериях и капиллярах, но не в венах.
О важности этого лиганда свидетельствует эмбриональная гибель мышей, утративших один аллель D11-4. При ангиогенезе ведущая клетка, называемая направляющей, делится и мигрирует, а стебельковые клетки поддерживают связь с существующим сосудом. VEGF индуцирует D11-4 в направляющей клетке, в то время как Notch-1 и Notch-4 экспрессируются в стебельковых клетках.
Взаимодействие между D11-4 и рецепторами Notch в соседствующих направляющих и стебельковых клетках приводит к двухступенчатому протеолитическому расщеплению рецептора. Внутриклеточный домен Notch высвобождается и перемещается в ядро и активирует гены, уменьшающие чувствительность к VEGF. Блокада D11-4 приводит к усилению пролиферации эндотелиальных клеток и капиллярному прорастанию. Блокада VEGF имеет противоположный эффект, а также приводит к снижению выживаемости эндотелиальных клеток.
Независимо от причины, вызвавшей образование капилляров, новообразованные сосуды хрупкие и им необходимо стабилизироваться. Для стабилизации нужны перициты, клетки гладких мышц (периэндотелиальные клетки) и отложение белков ВКМ. В процессе стабилизации также участвуют ангиопоэтин 1 (Angl) и ангиопоэтин 2 (Ang2), PDGF и TGF-b. Angl взаимодействует с рецептором на эндотелиальных клетках, называемым Tie2, что способствует привлечению периэндотелиальных клеток.
PDGF участвует в миграции клеток гладких мышц, тогда как TGF-b стабилизирует новые сосуды путем увеличения образования белков ВКМ. Взаимодействие Angl-Tie2 регулирует процесс созревания сосудов (от простых эндотелиальных трубок до более сложных сосудистых структур) и поддерживает покоящееся состояние эндотелия. Напротив, Ang2, также взаимодействующий с Tie2, дает обратный эффект, повышая чувствительность к стимулам факторов роста, таких как VEGF, или к ингибиторам ангиогенеза (в отсутствие VEGF).
Доказательством большого значения этих молекул является существование генетического заболевания вследствие мутаций гена Tie2, характеризующегося венозной мальформацией.
Агенты или условия, стимулирующие экспрессию VEGF, такие как некоторые цитокины, факторы роста (например, TGF-b, PDGF, TGF-a) и особенно тканевая гипоксия, могут влиять на физиологический и патологический ангиогенез. Транскрипция VEGF регулируется фактором транскрипции HIF.

(А) При ангиогенезе из предсуществующих сосудов эндотелиальные клетки этих сосудов приобретают подвижность и начинают делиться с образованием капиллярных ростков.
Независимо от начального механизма созревание (стабилизация) сосудов включает привлечение перицитов и клеток гладких мышц для формирования периэндотелиального слоя.
(Б) Эндотелиальные клетки-предшественники могут быть привлечены из костного мозга и мигрировать в места травмы или опухолевого роста.
Далее эти клетки дифференцируются и формируют в очаге зрелую сеть сосудов, связанную с уже существующими сосудами.
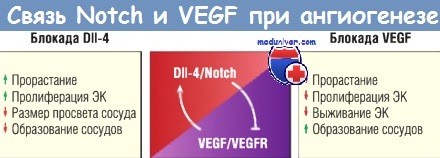
VEGF стимулирует дельтаподобный лиганд 4 (DII-4)/Notch, который ингибирует передачу сигнала VEGFR.
По сравнению с интактным ангиогенезом блокада DII-4 приводит к увеличению прорастания капилляров и пролиферации эндотелиальных клеток (ЭК) и образованию сосудов, которые дезорганизованы и имеют небольшой диаметр просвета.
Блокада VEGF уменьшает прорастание капилляров, пролиферацию и выживаемость ЭК.
VEGF — сосудистый эндотелиальный фактор роста; VEGFR — рецептор сосудистого эндотелиального фактора роста.
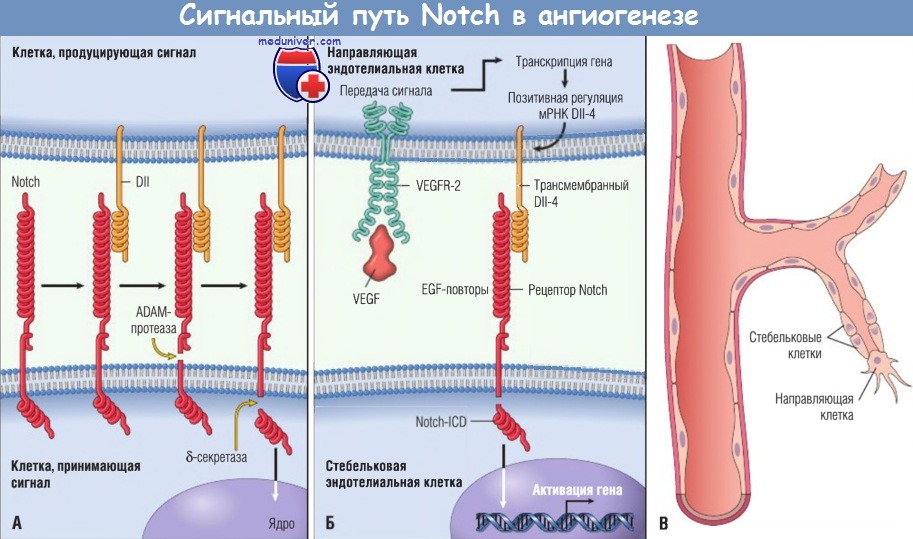
(А) Рецептор Notch связывает дельтаподобный лиганд (DII), расположенный в соседней клетке, и дважды протеолитически расщепляется (первое расщепление с участием ADAM-протеазы, второе — 5-секретазы),
высвобождая С-концевой фрагмент, известный как внутриклеточный сигнальный домен Notch (Notch-ICD).
(Б) Сигнальный путь Notch при ангиогенезе, запускаемый связыванием DII-4 в направляющей эндотелиальной клетке, с рецептором Notch на стебельковой эндотелиальной клетке.
Notch-ICD мигрирует в ядро и активирует транскрипцию генов-мишеней. (В) Рост нового сосуда при ангиогенезе.
Показана миграция направляющей и стебельковой клеток, связанных с эндотелиальными клетками основного сосуда.
EGF — эпидермальный фактор роста; VEGF — сосудистый эндотелиальный фактор роста;
VEGFR — рецептор сосудистого эндотелиального фактора роста; мРНК — матричная рибонуклеиновая кислота.
- Рекомендуем ознакомиться со следующей статьей "Участие белков межклеточного вещества в регуляции ангиогенеза"
Оглавление темы "Патофизиология заживления тканей":- Эластин и фибриллин межклеточного вещества (внеклеточного матрикса)
- Белки клеточной адгезии межклеточного вещества (внеклеточного матрикса)
- Гликозаминогликаны и протеогликаны межклеточного вещества (внеклеточного матрикса)
- Этапы заживления ткани путем репарации
- Механизмы ангиогенеза в тканях и ее типы
- Сосудистый фактор роста и рецепторы в регуляции ангиогенеза
- Участие белков межклеточного вещества в регуляции ангиогенеза
- Этапы заживления кожной раны
- Факторы влияющие на скорость заживления раны
- Причины нарушений заживления раны (репарации)

