Строение, функции основного вещества. Гистология
Межклеточное основное вещество является высокогидратированной, бесцветной и прозрачной сложной смесью макромолекул. Оно заполняет пространства между клетками и волокнами соединительной ткани и, поскольку оно обладает вязкостью, играет ролькак смазки, так и барьера, препятствующего проникновению инородных частиц. При хорошей фиксации на гистологических препаратах его компоненты агрегируют и осаждаются в тканях в виде зернистого материала, который наблюдается на электронномикроскопических препаратах в виде электронноплотных филаментов или гранул. Основное вещество образуют главным образом три класса компонентов: гликозаминогликаны, протеогликаны и мультиадгезивные гликопротеины.
Гликозаминогликаны (первоначальное название — кислые мукополисахариды) являются линейными полисахаридами, образованными повторяющимися дисахаридными единицами, которые обычно состоят из уроновой кислоты и гексозамина. В качестве гексозамина может быть глюкозамин или галактозамин, а уроновой кислоты — глюкуроновая или идуроновая кислоты. За исключением гиалуроновой кислоты, эти линейные цепи ковалентно связаны со стержневым белком, в результате чего образуется молекула протеогликана. Вследствие изобилия гидроксильных, карбоксильных и сульфатных групп в углеводной части большинства гликозаминогликанов, эти молекулы являются резко гидрофильными и обладают свойствами полианионов. За исключением гиалуроновой кислоты, все остальные гликозаминогликаны у взрослых до определенной степени сульфатированы. На углеводную часть протеогликанов приходится 80—90% массы их макромолекулы.
Благодаря таким характеристикам протеогликаны способны связываться с большим числом катионов (обычно натрием) посредством электростатических (ионных) связей. Протеогликаны представляют собой резко гидратированные структуры с толстым слоем сольватационной воды, окружающим молекулу. При полной гидратации протеогликаны заполняют значительно больший объем (домен), чем в безводном состоянии, и обладают высокой вязкостью.
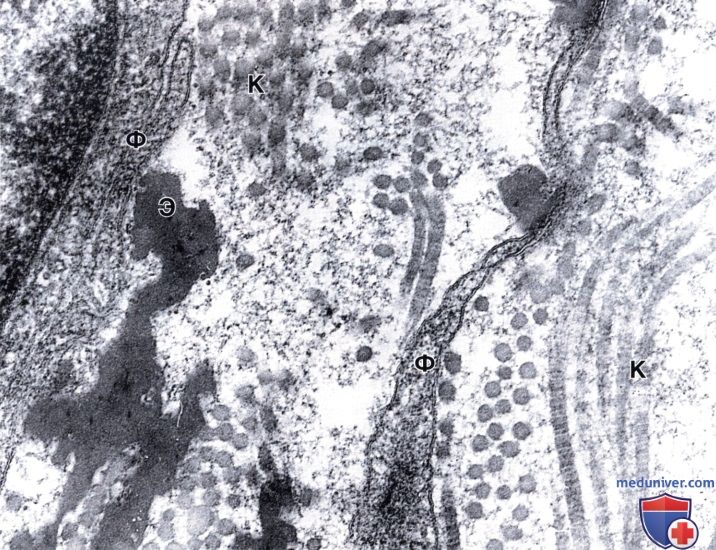
Основное вещество имеет вид мелкозернистого материала, который заполняет пространства между коллагеновыми (К) и эластическими (Э) волокнами и окружает тела и отростки фибробластов (Ф).
Зернистость основного вещества является артефактом фиксации глютаральдегидом — танниновой кислотой. Электронная микрофотография, х100 000.
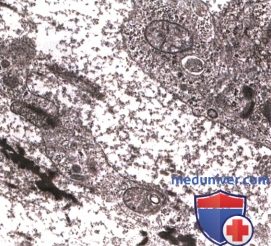
Сеть протеогликанов заполняет межклеточные пространства. Некоторые протеогликановые филаменты находятся в тесном контакте с клеточной поверхностью. Среднее увеличение.
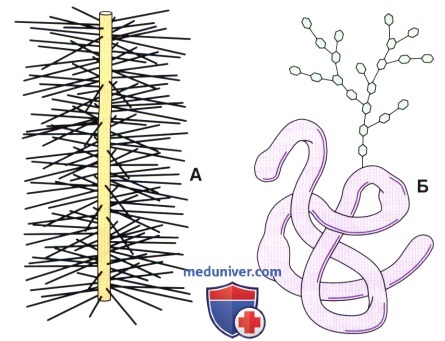
А — протеогликаны содержат осевой белок (вертикальный стержень на рисунке), с которым ковалентно связаны молекулы гликозаминогликанов (ГАГ).
ГАГ представляет собой неразветвленный полисахарид, состоящий из повторяющихся дисахаридов; одним из компонентов является аминосахар, другим — уроновая кислота.
Протеогликаны содержат большее количество углеводов, чем гликопротеины.
Б — гликопротеины являются глобулярными белковыми молекулами, к которым ковалентно прикреплены ветвящиеся цепи моносахаридов.
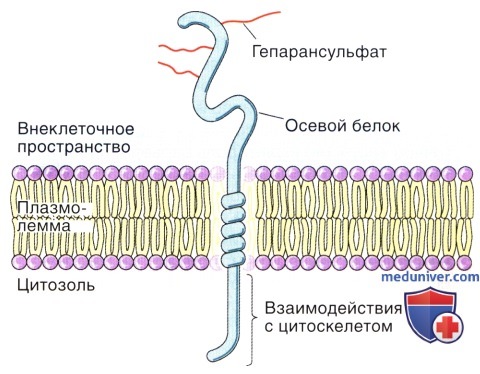
Стержневой белок пронизывает плазматическую мембрану посредством цитоплазматического домена.
Синдекановые протеогликаны содержат три цепи гепарансульфата, иногда — хондроитинсульфата.
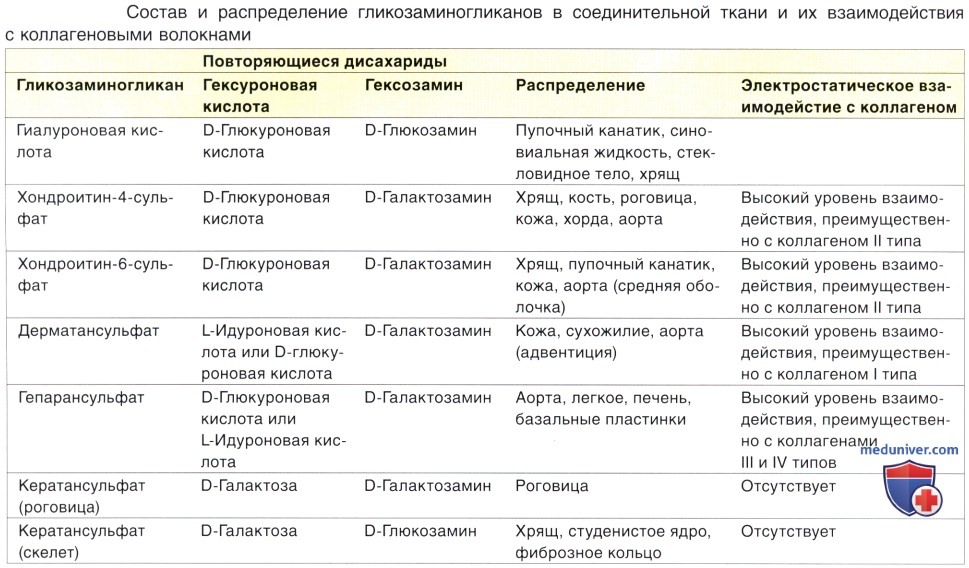
Протеогликаны состоят из стержневого белка, связанного с четырьмя главными гликозаминогликанами, включающими дерматансульфат, хондроитинсульфат, кератансульфат и гепарансульфат. В таблице ниже приведены химический состав и тканевое распределение гликозаминогликанов и протеогликанов. Протеогликан представляет собой трехмерную структуру, которую можно представить как щетку («ершик») для мытья пробирок: в ней удлиненная основа соответствует стержневому белку, а щетинки — гликозаминогликанам. Установлено, что в хряще молекулы протеогликанов связаны с цепью гиалуроновой кислоты, образуя крупные молекулы — агрегаты протеогликанов. Кислотные группы протеогликанов обусловливают прикрепление этих молекул к основным аминокислотным остаткам коллагена.
Протеогликанам свойственно молекулярное разнообразие; их можно выявить в цитоплазматических гранулах (как, например, гепарин — в тучных клетках), на клеточной поверхности и в межклеточном веществе. В одном межклеточном веществе могут содержаться несколько различных типов стержневых белков, причем каждый может быть связан с разным числом гликозаминогликанов разной длины и состава. Одним из наиболее важных протеогликанов межклеточного вещества является аггрекан, который представляет собой преобладающий протеогликан хряща. В аггрекане несколько молекул протеогликанов (содержащих цепи хондроитинсульфата) нековалентно связаны стержневым белком с молекулой гиалуроновой кислоты. Протеогликаны клеточной поверхности прикреплены к плазматической мембране клеток многих типов, в особенности, эпителиальных клеток. В качестве двух примеров можно привести синдекан и фиброгликан. Стержневой белок протеогликанов клеточной поверхности пронизывает плазматическую мембрану, продолжаясь в виде короткой цитозольной цепи.
Небольшое количество цепей гликозаминогликанов гепарансульфата или хондроитинсульфата прикреплено к внеклеточной части осевого белка (рис. 5-33).
Помимо того, что как внеклеточные, так и поверхностные протеогликаны выполняют роль структурных компонентов межклеточного вещества и элементов, прикрепляющих клетки к межклеточному веществу, они также связывают многочисленные белковые факторы роста, например трансформирующий фактор роста (TGF-P).
Синтез протеогликанов начинается в грЭПС, где происходит образование белковой части молекулы. Гликозилирование первоначально протекает в грЭПС и завершается в комплексе Гольджи, где осуществляется также сульфатирование.
Мультиадгезивные гликопротеины являются соединениями, состоящими из белковой части, к которой прикреплены углеводы. В отличие от протеогликанов, белковая часть в них обычно является преобладающей, причем в этих молекулах нет линейных полисахаридов, образованных повторяющимися дисахаридами, содержащими гексозамины. Вместо этого углеводная часть гликопротеинов часто представляет собой разветвленную структуру.
Медицинское значение. Разрушение протеогликанов осуществляется несколькими типами клеток и зависит от присутствия ряда лизосомальных ферментов. Описаны некоторые расстройства, при которых недостаточность лизосомальных ферментов вызывает блокирование разрушения гликозаминогликанов с последующим накоплением этих веществ в тканях. Обнаружено, что отсутствие специфических гидролаз в лизосомах является причиной ряда расстройств у человека, включая синдромы Хюрлера, Хантера, Санфилиппо и Моркио. Вследствие своей высокой вязкости межклеточное вещество играет роль барьера, препятствующего проникновению бактерий и других микроорганизмов. Поэтому фермент гиалуронидаза, гидролизующий гиалуроновую кислоту и другие гликозаминогликаны, продуцируемый некоторыми бактериями, придает им высокую способность к внедрению (инвазии) в ткани, поскольку он снижает вязкость основного вещества соединительной ткани.
Из соединительной ткани выделено несколько гликопротеинов, которые играют важную роль не только во взаимодействии между соседними клетками у взрослого и эмбриона, но и в адгезии клеток к их субстратам. Фибронектин (лат. fibra — волокно + nexus — соединение) — это гликопротеин, синтезируемый фибробластами и некоторыми эпителиальными клетками. Его молекула массой 222— 240 кДальтон обладает участками связывания клеток, коллагена и гликозаминогликанов. Взаимодействия в этих участках способствуют осуществлению нормальной адгезии и миграции клетки. Фибронектин распределен в виде сети в межклеточных пространствах многих тканей. Ламинин представляет собой крупный гликопротеин, участвующий в адгезии эпителиальных клеток к базальной пластинке, которая является структурой, богатой ламинином.
Взаимодействие клеток с компонентами межклеточного вещества опосредуют поверхностные клеточные молекулы (рецепторы матрикса), которые связываются с коллагеном, фибронектином и ламинином. Этими рецепторами являются интегрины — семейство трансмембранных связующих белков. Интегрины связываются со своими лигандами в межклеточном веществе со сравнительно низкой аффинностью, что позволяет клетке обследовать свое окружение, не утрачивая прикрепления к матриксу и не оказываясь прочно связанной с ним. Очевидно, что интегрины должны взаимодействовать с цитоскелетом, обычно актиновыми микрофиламентами. Взаимодействия между интегринами, межклеточным веществом и элементами цитоскелета опосредованы несколькими продукты метаболизма к органам детоксикации и выделения, таким, как печень и почки.
На воду, содержащуюся в капиллярах, действуют две силы: гидростатическое давление крови, результат насосного действия сердца, которое заставляет воду перемещаться через стенку капилляра, и коллоидное осмотическое давление плазмы крови, которое притягивает воду назад в капилляры. Осмотическое давление обусловлено преимущественно белками плазмы. Поскольку ионы и вещества с низкой молекулярной массой свободно проходят через стенки капилляров, их концентрация внутри этих кровеносных сосудов и за их пределами примерно одинакова, а осмотическое давление, которое они обусловливают, приблизительно равно по обеим сторонам капилляра, сводя различия к нулю. Коллоидное осмотическое давление, вызываемое макромолекулами белков крови, которые не способны проходить через стенку кровеносных сосудов, не уравновешивается наружным давлением и стремится вернуть воду назад в кровеносный сосуд.
В нормальных условиях вода проходит через стенку капилляра в окружающие ткани у артериального края капилляра, потому что гидростатическое давление здесь выше, чем коллоидное осмотическое давление; гидростатическое давление, однако, снижается по длине капилляра в направлении венозного края. По мере того, как снижается гидростатическое давление, осмотическое давление нарастает вследствие прогрессивного увеличения концентрации белков, что вызвано выделением воды из капилляров. В результате этого нарастания концентрации белка и снижения гидростатического давления осмотическое давление становится больше, чем гидростатическое давление у венозного края капилляра, и вода привлекается назад в капилляр. Таким путем в соединительной ткани циркулируют метаболиты, питая ее клетки.
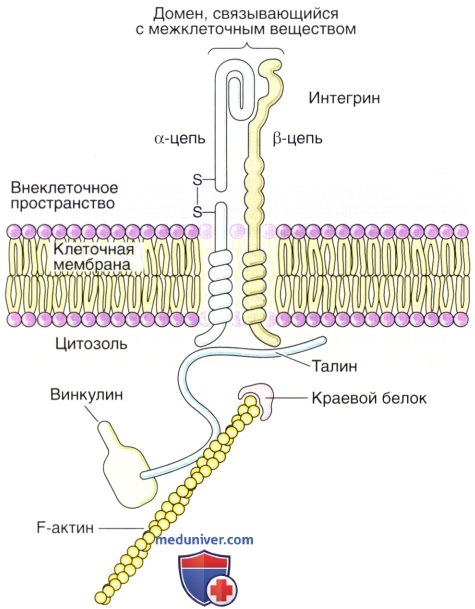
Связываясь с белком межклеточного вещества и с актиновым цитоскелетом (через а-актинин) внутри клетки, интегрин служит трансмембранным связующим элементом.
Молекула интегрина представляет собой гетеродимер с α- и β-цепями. «Головка» молекулы может выступать над поверхностью клеточной мембраны в сторону межклеточного вещества примерно на 20 нм.
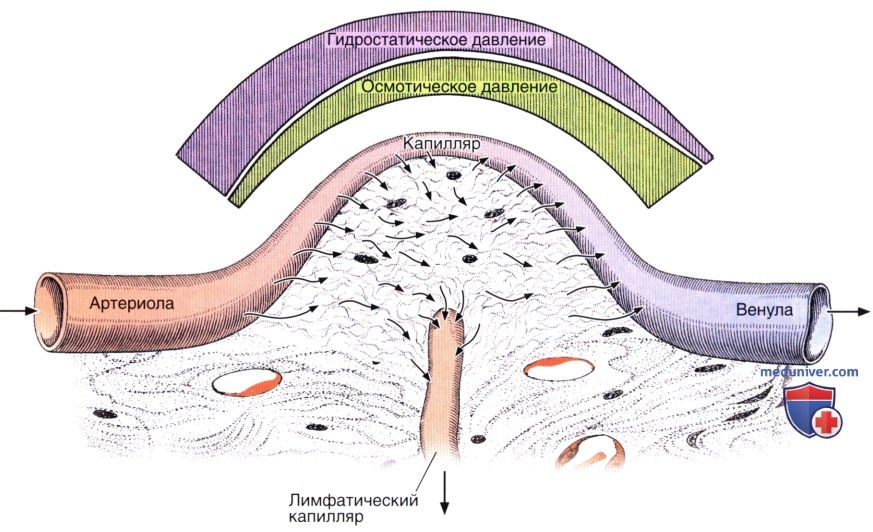
Жидкость покидает капилляр через его артериальный край и возвращается в кровь через венозный. Часть жидкости удаляется лимфатическими капиллярами.
Количество воды, которое возвращается в сосуды, меньше, чем то количество, которое выделяется в ткани через капилляры. Вода, задерживающаяся в соединительной ткани, возвращается в кровь через лимфатические сосуды. Самыми мелкими лимфатическими сосудами являются лимфатические капилляры, которые начинаются в соединительной ткани своими закрытыми концами. Лимфатические сосуды открываются в вены у основания шеи.
Вследствие равновесия, которое существует между водой, проникающей в межклеточное вещество соединительной ткани и покидающей его, в самой ткани содержится лишь небольшое количество свободной воды. В некоторых патологических состояниях объем тканевой жидкости может существенно увеличиваться, вызывая отек. На гистологических срезах это состояние характеризуется расширением пространств между компонентами соединительной ткани, которое обусловлено нарастанием содержания жидкости. Макроскопически при отеке происходит увеличение объема ткани, которая легко уступает воздействию: при надавливании на участок ткани появляется медленно исчезающая ямка.
Отек может возникать вследствие нарушения оттока по венозным или лимфатическим сосудам из-за их непроходимости, а также при снижении венозного кровотока (например, при застойной сердечной недостаточности). Он можетявиться также результатом закупорки лимфатических сосудов паразитическими эмболами или опухолевыми клетками или быть следствием хронического голодания. Белковая недостаточность приводит к дефициту белков в плазме и снижению коллоидного осмотического давления. Вода при этом накапливается в соединительной ткани и не возвращается назад в капилляры.
Другой возможной причиной отека является увеличенная проницаемость эндотелия кровеносных капилляров или посткапиллярных венул вследствие химического, механического повреждения или выделения некоторых веществ, продуцируемых в организме (например, гистамина).
Медицинское значение. Отек возникает в результате накопления воды в межклеточных пространствах. Вода в межклеточном компартменте соединительной ткани происходит из крови вследствие ее перемещения через стенку капилляров. Стенка капилляров лишь слегка проницаема для макромолекул, но пропускает воду и мелкие молекулы, включая белки с низкой молекулярной массой.
- Читать далее "Типы собственно соединительной ткани. Гистология"
Оглавление темы "Гистология соединительной и жировой ткани":- Строение, функции ретикулярных волокон. Гистология
- Строение, функции эластических волокон. Гистология
- Строение, функции основного вещества. Гистология
- Типы собственно соединительной ткани. Гистология
- Строение эластической, ретикулярной, слизистой тканей. Гистология
- Функция, типы жировой ткани
- Строение однокапельной жировой ткани. Гистология
- Накопление и мобилизация липидов. Как накапливаются жиры?
- Гистогенез однокапельной жировой ткани. Как образуются жировые клетки?
- Строение бурой (многокапельной) жировой ткани. Гистология

