Новые молекулярные мишени рака кожи используемые для их лечения
Значительный прогресс в нашем понимании факторов, участвующих в патогенезе опухолей кожи, обещает открытие новых подходов в терапии и профилактике. Помимо выявления новых терапевтических мишеней, были разработаны улучшенные стратегии влияния на гены и функции белка с большой селективностью.
Обилие и исключительная доступность раковых опухолей кожи и предраковых заболеваний для исследования делает их основным предметом изучения в клинических испытаниях. Исходя из описанных выше фундаментальных исследований, потенциальными терапевтическими мишенями являются р53; СОХ-2; теломераза; EGFR или другие рецепторные тирозинкиназы и элементы внутриклеточной сигнализации, такие как SOS; Ras; орнитин декарбоксилаза; механизм репарации ДНК; ММП; ПКС; молекулы, участвующие в прогрессии клеточного цикла, такие как циклины D1 и D2, CDK4, p16INK4a, и E2F1; рецепторы ретиноидов и c-Fos. Во всех случаях возможная эффективность предлагаемых методов лечения требует тщательной оценки на моделях животных или тканях человека, выращенных на иммунодефицитных мышах.
Хотя подавляющее большинство случаев плоскоклеточной карциномы (ПКР) эффективно лечатся хирургическими методами или посредством лучевой терапии, дерматологическим пациентам, скорее всего, помогли бы такие препараты, которые предотвращают появление предзлокачественных очагов, блокируют прогрессию неоплазий в плоскоклеточный рак кожи (ПКР) или вызывают абляцию опухоли при минимально инвазивных методах, особенно в косметически чувствительных участках. Помимо этих направлений исследований, в двойном слепом исследовании было показано значительное уменьшение частоты развития актинического кератоза и базальноклеточной карциномы (БРК) у пациентов с пигментной ксеродермой, получавших местное лечение ферментами репарации ДНК Т4 эндонуклеазой V в течение одного года.
Патогенетические мутации в BRAF недавно использовали для терапии меланомы, и в перспективном испытании фазы I с применением мутированного ингибитора BRAF у большинства пациентов с меланомами, имевших мутацию V600E BRAF, наблюдался либо частичный, либо полный ответ на терапию.
В отличие от множества генетических и биохимических изменений, ассоциированных с развитием плоскоклеточного рака кожи (ПРК), в большинстве случаев базальноклеточного рака кожи (БРК) отмечаются мутации в РТСН1 или SMO, и, что важнее всего, все эти опухоли обнаруживают неконтролируемую активацию сигнального пути Hh. Поскольку ряд экспериментальных моделей указывает на центральную роль нарушений в сигнальном пути Hh для развития и поддержания базальноклеточного рака кожи (БРК), этот путь становится главной мишенью для разработки лекарственного препарата, целенаправленно воздействующего на этот механизм.
Циклопамин и связанные с ним молекулы блокируют передачу сигналов в Hh-пути путем подавления функции SMO, их блокирующее действие на рост БРК-подобных и других «Hh-активируемых» опухолей было показано в доклинических исследованиях.
В клинических испытаниях фазы I системный антагонист Hh-пути показал перспективные результаты у пациентов с базальноклеточным раком кожи (БКР) в поздних и метастазирующих стадиях, что внушает надежду на возможность терапии этих видов рака и многих других злокачественных опухолей, связанных с нарушением Hh-сигнализации, с помощью антагонистов сигнального пути Hh.
Базальноклеточнй рак кожи (БРК) редко бывает летальным, но частое развитие этого вида рака на открытых солнцу и косметически чувствительных участках усиливает потребность в медицинском подходе к таким опухолям, особенно если антагонист сигнального пути Hh окажется эффективным в терапии или профилактике развития опухолей у лиц из группы высокого риска, в том числе с невоидным синдромом базальноклеточного рака кожи (БКР). В настоявшее время идут дополнительные испытания при базальноклеточном раке кожи (БКР) у пациентов с применением как системных, так и местных антагонистов Hh-пути, и, если их эффективность будет доказана при приемлемом профиле безопасности, наш подход к терапии этих чрезвычайно распространенных видов раковых опухолей может измениться. С учетом прогресса в фундаментальном понимании патогенеза немеланомного рака кожи, мы можем надеяться на появление последующих, целенаправленно разработанных терапевтических средств для дополнения, а в некоторых случаях, возможно, и для замещения хирургического лечения.
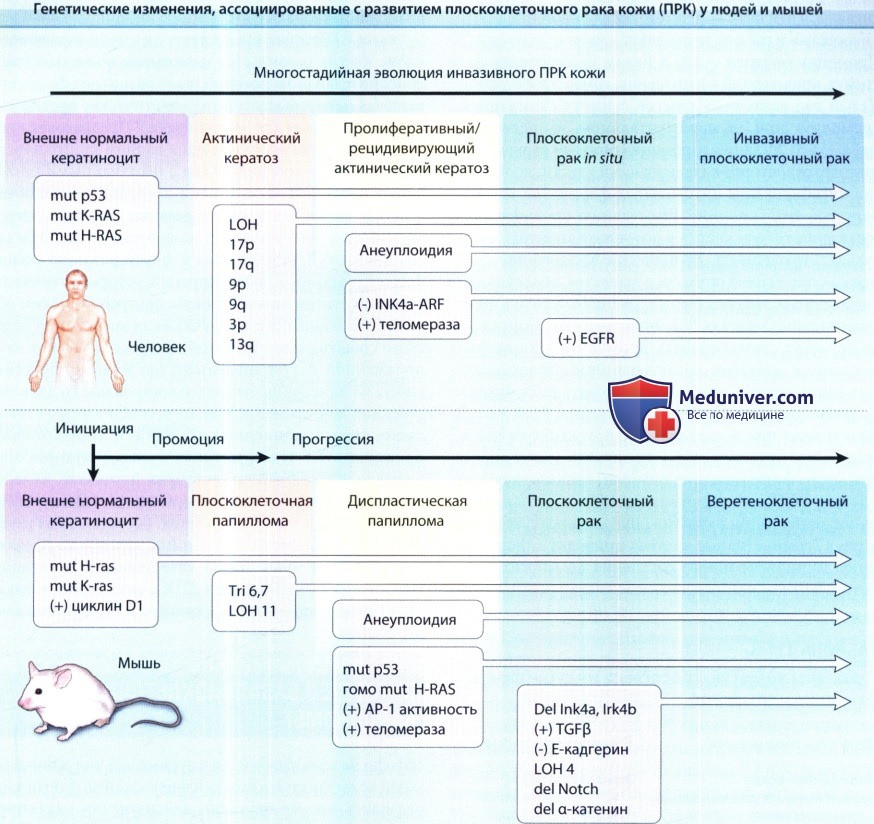
многостадийная эволюция инвазивного ПРК кожи у человека с часто ассоциированными генетическими изменениями.
Мутации одного основания в очагах поражения на ранних стадиях часто характерны для УФ-индуцированного повреждения, тогда как позднее развивающиеся изменения ассоциированы с геномной нестабильностью.
В результате эпигенетических изменений также может развиваться увеличение активности теломеразы (делеция ингибитора) или тирозинкиназы рецептора эпидермального фактора роста (EGFR) (амплификация гена).
При химически индуцированном ПРК кожи многостадийная эволюция в веретеноклеточную опухоль в этой модели является высокоупорядоченным процессом как с временной, так и с генетической точки зрения.
Операционально определенные стадии включают инициацию, промоцию и прогрессию.
Мутация Ras характерна для химических мутагенов, используемых для инициации образования опухоли.
Раннее повышение активности циклина-D1 и позднее повышение активности трансформирующего фактора роста- β1 (TGF- β1), по-видимому, являются важными компонентами канцерогенеза.
Следует отметить, что хотя повреждение р53 выявляется на ранних стадиях развития ПРК человека и при развития УФ-индуцированного ПРК у мышей (не показано), в процессе химического канцерогенеза у мышей мутации р53 возникают на более поздних стадиях.
АР-1 — активирующий белок 1; LOH — потеря гетерозиготности; mut — мутант.
- Рекомендуем далее ознакомиться со статьей "Ультрафиолетовое облучение солнца и солярия как причина рака кожи"
Оглавление темы "Патогенез рака кожи.":- Общие принципы развития рака кожи (патогенез)
- Механизм развития базальноклеточного рака кожи (патогенез базальноклеточной карциномы)
- Механизм развития плоскоклеточного рака кожи (патогенез плоскоклеточной карциномы)
- Врожденные и внешние факторы влияющие на прогноз рака кожи (модификаторы канцерогенеза)
- Новые молекулярные мишени рака кожи используемые для их лечения
- Ультрафиолетовое облучение солнца и солярия как причина рака кожи
- Повреждение ДНК и мутации под действием ультрафиолета как причина рака кожи
- Этапы развития рака кожи вызванного ультрафиолетовым облучением
- Наследственные факторы риска рака кожи от ультрафиолета
- Меры профилактики рака кожи от ультрафиолета (солнца, солярия)

