Структура хромосомы и генов человека
Хромосомы человека имеют общие черты строения. Все хромосомы состоят из двух плеч, обозначенных как «р» и «q». Если плечи неодинаковой длины, короткое плечо всегда обозначается «р». Для выявления аномалий на хромосомной карте хромосомы представлены в метафазе митоза в конденсированном состоянии с нанесенными полосами. Во время интерфазы деконденсированные хромосомы при использовании обычных микроскопов не различимы.
В настоящее время гены могут быть локализованы с абсолютной точностью до одной пары оснований, которые они занимают внутри последовательности ДНК данной хромосомы. Полосы пронумерованы от центромеры кнаружи по системе, включающей дискриминационную окраску хромосомы, тем более различающуюся, чем выше становится доступная разрешающая способность светового микроскопа. Типичная цитогенетическая хромосомная полоска — это 17q21.2, в которой располагается ген кератина I.
Концевые участки плеч хромосом, называемые теломерами, состоят из многочисленных тандемных повторов коротких последовательностей ДНК. В половых и некоторых других типах клеток дополнительные повторы добавляются к теломерам с помощью рибонуклеопротеидного ферментативного комплекса — теломеразы. Во время каждого клеточного деления в соматических клетках один из повторов в теломере выбрасывается из цепочки ДНК вследствие репликации. Измеряя длину теломер, можно определить «возраст» соматических клеток, измеренный в количестве делений, которые они прошли на протяжении жизни всего организма.
Когда длина теломерных участков становится меньше определенной пороговой величины, клетка подвергается старению. Так, теломеры выполняют важную функцию биологических часов, которые удаляют соматические клетки, которые слишком много раз прошли репликацию и имеют высокий риск накопления мутаций, что может привести к развитию опухолевого процесса или другим функциональным нарушениям.
Плечи хромосом разделены центромерой, которая является длинным участком высокоповторяющейся ДНК. Центромеры выполняют важную функцию при движении и взаимодействии хромосом. Центромеры сестринских хроматид — это участки, в которых удвоенные хромосомы выстраиваются и прикрепляются друг к другу во время профазы и анафазы митоза (и мейоза). Центромеры сестринских хроматид также являются местами формирования кинетохор. Кинетохор является мультибелковым комплексом, к которому прикрепляются микротрубочки, что дает возможность для формирования митотического веретена деления, которое приводит к растаскиванию хроматид во время анафазы цикла клеточного деления.
Большая часть ДНК хромосом содержит гены, в которые вкраплены некодирующие участки ДНК различных размеров. Плотность генов на хромосоме варьирует в широких пределах, есть участки, богатые генами и, напротив, обширные участки, практически лишенные функциональных генов. Примером сравнительно богатого генами участка, имеющего особое значение для наследования кожных заболеваний, является кластер генов кератина I типа на хромосомной полоске 17q21.2. Диаграмма также дает представление о размерах ДНК типичной хромосомы в нуклеотидных парах и о типичном гене, который в ней локализован. Кластер генов насчитывает около 900000 пар нуклеотидных оснований и содержит 27 генов кератина функционального класса I, несколько генов, кодирующих кератин-ассоции-рованные белки, а также псевдогены (не показаны).
Хромосома 17 является одной из мелких хромосом, поэтому рисунок ниже дает только первоначальное представление об общей сложности и организации генома.
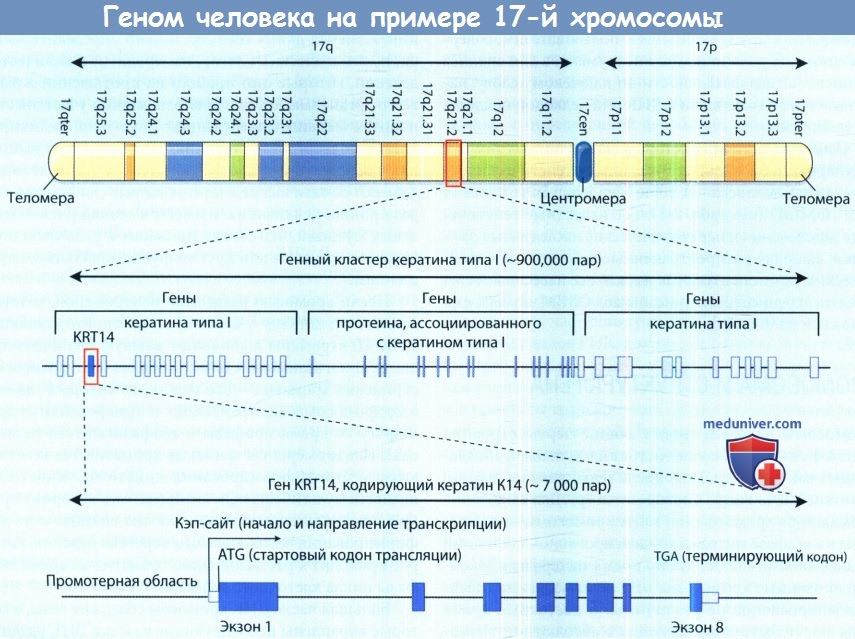
Слева короткое (р) и длинное (q) плечо хромосомы 17 человека изображены с нанесением цитогенетических хромосомных полос.
Один из этих участков, 17q21.2, выделен, чтобы показать, что он состоит приблизительно из 900000 пар оснований и содержит несколько генов, включая 27 типов кератина функционального типа I.
Этот участок увеличен для того, чтобы показать один ген кератина, KRT14, кодирующий кератин 14 и состоящий из 8 экзонов.
Гены, кодирующие белки, обычно состоят из нескольких экзонов, которые вместе кодируют последовательность аминокислот в белке (открытая рамка считывания). Экзоны разделены некодирующими нитронами. В человеческих генах размер нескольких экзонов превосходит 1000 нуклеотидных пар (н.п.), а размер нитронов колеблется от менее 100 н.п. до более чем 1 млн. н.п. Типичный экзон имеет размеры 100-300 н.п. Ген KRT14, кодирующий кератин-14 или белок К14, показанный на рисунке ниже, является одним из тех генов, мутации в котором приводят к развитию простой формы буллезного эпидермолиза. В гене KRT14 находится около 7000 н.п. ДНК, он состоит из 8 экзонов небольших размеров, перемежающихся с 7 маленькими нитронами. Хотя все гены присутствуют во всех человеческих клетках, содержащих ядро, не каждый ген экспрессируется во всех клетках определенной ткани.
Например, ген KRT14 активен только в кератиноцитах базального слоя эпидермиса, в многослойном эпителии и не экспрессируется в других тканях. Когда белоккодирующий ген экспрессируется, фермент РНК-полимераза II типа транскрибирует кодирующую цепь ДНК гена с кэп-сайта до конца последнего экзона, где различные сигналы приводят к завершению транскрипции. Исходный РНК-транскрипт, известный как гетеронуклеарная РНК, содержит последовательности как экзонов, так и интронов. Этот первичный транскрипт подвергается сплайсингу для удаления/выщепления интронов, в результате чего образуется молекула матричной РНК (мРНК).
Кроме того, основания на 5’-конце (начало) мРНК химически модифицируются (копируются), а к 3’-концу добавляется огромное число оснований аденозина — так называемый поли-А хвост. Эти посттранскрипционные модификации стабилизируют мРНК и облегчают ее транспорт внутри клетки. Зрелая мРНК проходит проверочную трансляцию, и если она удачна, то мРНК транспортируется в цитоплазму, где она будет транслироваться множество раз с помощью рибосом, что приводит к накоплению кодировавшегося белка. Если мРНК содержит нонсенс-мутацию, которая известна как мутация преждевременного появления кодона терминации, проверочная трансляция не состоится, и клетка разрушит эту мРНК через нонсенс-опосредованный путь деградации мРНК. Это механизм, который клетки приобрели во время эволюции для того, чтобы удалять неправильные транскрипты; его можно также отнести к механизмам регуляции генов, особенно когда в данной клетке требуется поддерживать очень низкий уровень определенного белка.
Сплайсинг нитронов — сложный процесс. Гены прокариот, таких как бактерии, не содержат нитронов, и поэтому мРНК сплайсинг — это процесс, специфичный для высших организмов [эукариот]. У некоторых примитивных эукариот молекулы РНК содержат каталитические последовательности, известные как рибозимы, которые катализируют само-сплайсинг интронов без необходимости в каких-либо дополнительных факторах. У млекопитающих в процесс сплайсинга вовлечено большое количество белков и РНК-факторов, закодированных несколькими генами. Это позволяет иметь другой уровень контроля над экспрессией генов, а также облегчает альтернативный сплайсинг экзонов таким образом, что один ген может кодировать несколько функционально различных вариантов белка. Эти изоформы часто экспрессируются дифференциально в разных тканях.
Для сплайсинга важны несколько пар нуклеотидов в начале и в конце интрона, известные как 5’-сайт сплайсинга (или донорский сайт сплайсинга) и 3’-сайт сплайсинга (или акцепторный сайт сплайсинга). Несколько других нуклеотидных пар в составе интрона, такие как сайт точки ветвления, локализованный от 18 до 100 пары нуклеотидов после/от 3’-конца, также имеют большое значение. Мутации, затрагивающие любой из инвариантных остатков в этих сайтах сплайсинга, ведут к ошибочному сплайсингу и, таким образом, либо к полному отсутствию экспрессии белка, либо к синтезу неправильного белка.
Матричная РНК также содержит два нетранслируемых участка: (1) 5’UTR выше кодона инициации ATG и (2) 3’UTR после терминатора (стоп-кодона, роль которого могут выполнять TGA, ТАА и TAG). 5’UTR часто имеет интроны, a 3’UTR в более чем 99% генов млекопитающих не содержит интронов. Нонсенс-опосредованный путь распада/деградации мРНК узнает мутантные транскрипты, оценивая нахождение кодона терминации по отношению к нитронам. После естественного стоп-кодона всегда сразу же следует 3’UTR, который, в свою очередь, в норме не содержит никаких интронов. Если стоп-кодон находится в мРНК до места, где интрон должен быть подвергнут эксцизии, такая информация является мишенью для нонсенс-опосредованной деградации. Гены-исключения, которые содержат интроны в 3’UTR последовательности, экспрессируются в крайне низких количествах. Это один из способов, которыми клетка определяет, какое количество белка будет синтезировано от конкретного гена.
Сложность гена варьирует в широких пределах и необязательно связана с размером кодируемого белка. Некоторые гены состоят только из одного маленького экзона, как, например, гены семейства коннексинов, белков щелевых контактов. Такие гены, состоящие из одного экзона, можно быстро и недорого анализировать в плановом порядке. Напротив, ген коллагена VII типа, COL7A1, мутации в котором ведут к дистопической форме буллезного эпидермолиза, содержит 118 экзонов. Это означает, что для молекулярной диагностики у каждого пациента с дистрофическим буллезным эпидермолизом необходимо изолировать и анализировать 118 частей гена. Недавно было показано, что ген филагрина (FLG) в хромосоме 1 является каузативным геном, вызывающим отрубевидный ихтиоз, и геном предрасположенности к атопическому дерматиту и имеет всего 3 экзона.
При этом третий экзон FLG включает более чем 12000 н. п„ состоит из повторов последовательности по 1000 н.п. и варьирует в размерах от 12000 н.п. до 14000 н.п. у разных индивидов. Необычная структура таких генов, как COL7A1 или FLG, затрудняет рутинное секвенирование, делает его дорогим и требующим много времени.
- Рекомендуем далее ознакомиться со статьей "Механизмы и этапы экспрессии генов"
Оглавление темы "Генетика заболеваний кожи.":- Значение изучения генома человека в дерматологии
- Структура хромосомы и генов человека
- Механизмы и этапы экспрессии генов
- Выявление генов ответственных за заболевание
- Механизм мутации генов и их полиморфизм
- Менделевские болезни и варианты их наследования
- Хромосомные болезни с кожными проявлениями
- Митохондриальные болезни с кожными проявлениями
- Комплексная генетика кожных болезней
- Мозаицизм в генетике кожных болезней

