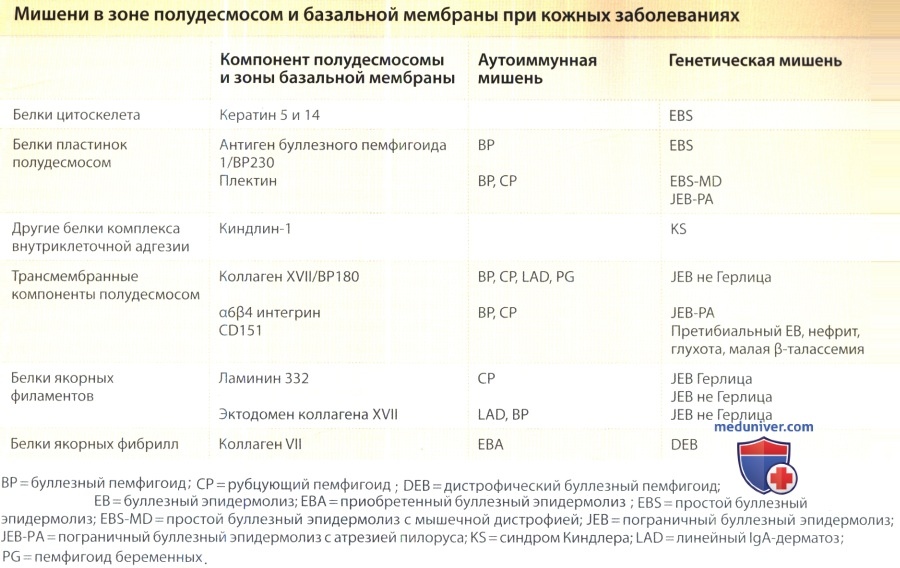
Строение полудесмосом базальной мембраны и их функции
На ультраструктурном уровне полудесмосомы во многом напоминают половинки десмомом межклеточных соединений эпидермиса. Однако компоненты двух этих структур различны. Антиген буллезного пемфигоида 1 с массой 230 кД (BPAG1 или ВР230) представляет собой суперспиральный димерный белок, гомологичный плакинам, которые связваются с промежуточными филаментами. BPAG1 является основным компонентом внутренней плотной пластинки полудесмосом.
Отсутствие BPAG1 у мышей и человека ассоциируется с простым буллезным эпидермолизом. Антиген буллезного пемфигоида 2 с массой 180кД (BPAG2 или ВР180) является основным антигеном при буллезом пемфигоиде и представляет собой трансмембранный коллаген, известный сейчас как коллаген XVII с внеклеточным коллагенозным доменом. Коллаген XVII фактически служит прототипом нового семейства коллагенозных трансмембранных белков — трансмембранных молекул типа II с одним или несколькими коллагенозными ответвлениями во внеклеточный домен.
Внутриклеточными лигандами коллагена XVII являются плектин, BPAG-1 и интегрин β4, а его внеклеточными лигандами — интегрин α6 и ламинин-332. Белок массой 120 кД представляет собой эктодомен коллагена XVII, который отделяется от клеточной поверхности протеиназами семейства ADAM (аббр. от англ. α disintegrin-like and metallo-proteinase-containing — А-дезинтегрин-подобные, содержащие металлопротеиназу [белки]) вследствие расщепления в юкстамембранном домене NC-16.
Мутации в коллагене XVII инициируют пограничный буллезный эидермолиз, что указывает на то, что коллаген XVII стабилизирует взаимодействия базальных кератиноцитов с базальной мембраной. Удаление у мыши гена Col17α1 привело к умеренному образованию пузырей, аномалиям зубов и поседению волос.
Плектин, еще один димерный гомолог плакина, также является компонентом полудесмосомы. Однако его локализация в ткани не ограничивается содержащими полудесмосомы базальными мембранами. Мутации плектина приводят к простому буллезному эпидермолизу и прогрессирующей мышечной дистрофии, а в некоторых случаях — к пограничному буллезному эпидермолизу с атрезией пилоруса, что говорит о важности плектина для стабильной адгезии клеток с базальной мембраной в различных тканях.
Одним из основных компонентов полудесмосом является интегрин α6β4. Он обладает высокой аффинностью к ламинину-332 и в связи с этим необходим для интеграции полудесмосомы с расположенными под ней базальной мембраной и стромой. Мутации в цепях α6 или β4 приводят к развитию пограничного буллезного эпидермолиза в сочетании с атрезией привратника.
Еще одним компонентом полудесмосомы является CD151 — трансмембранный белок семейства тетраспанинов, представители которого повсеместно экспрессированы на клеточной поверхности. Он образует комплексы с интегринами 3αβ1 и α6β4 у базолатеральной поверхности базальных кератиноцитов и стабилизирует их функции.
Распад комплексов CD151-интегрина приводит к ремоделированию взаимодействий эпителиальных клеток базальной мембраны и предоставляет клеткам возможность мигрировать. Косвенные данные о функциях CD151 были получены в ходе изучения редкого генетического заболевания у человека. CD151 экспрессирован в тканях таких органов, как кожа и почки; кроме того ген CD 151 кодирует MER2 — антиген группы крови на эритроцитах.
Также гомозиготные нулевые мутации CD151 были обнаружены у трех MER-2 негативных пациентов, страдавших наследственным нефритом, сенсорно-невральной глухотой, претибиальным буллезным эпидермолизом и малой β-талассемией. Перечисленные симптомы позволяют предположить, что CD151 является важным компонентом базальной мембраны почек, кожи и внутреннего уха, а также играет определенную роль в эритропоэзе.
Известно, что кроме компонентов полудесмомом на базально-латеральном участке базальных кератиноцитов присутствуют также и другие адгезивные молекулы, например, интегрин α3β1 — рецептор комплекса ламинина 332-311 в базальной мембране между полудесмосомами, а также еще один трансмембранный коллаген типа XIII. Поскольку in vitro указанные белки локализованы в фокальных контактах вместе с винкулином и талином, можно предположить, что они служат связующим звеном между базальной мембраной и сетью кортикального актина эпителия.
В ходе недавних генетических исследований был обнаружен новый внутриклеточный компонент этого комплекса — кинд-лин-1. Мутации гена киндлина-1 KINDL1 отмечаются при синдроме Киндлера — заболевании, сопровождающемся образованием пузырей в младенческом возрасте, прогрессирующей пойкилодермией, атрофией кожи, пигментными аномалиями и в некоторых случаях приводящем к раку кожи.
В эпидермисе киндлин-1 экспрессирован на базолатеральной поверхности базальных кератиноцитов, а в культивированных эпителиальных клетках он локализуется вместе с винкулином — маркером клеточно-матричных адгезий, опосредованных интегринами, а также с микрофиламентами актина. Данные факты свидетельствуют о том, что киндлин-1 необходим для стабильности дермо-эпидермального соединения, и что наряду с полудесмосомами сцепление актинового цитоскелета с локусами адгезии клеток и внеклеточного матрикса является альтернативным способом прикрепления базальных эпителиальных клеток к базальной мембране.
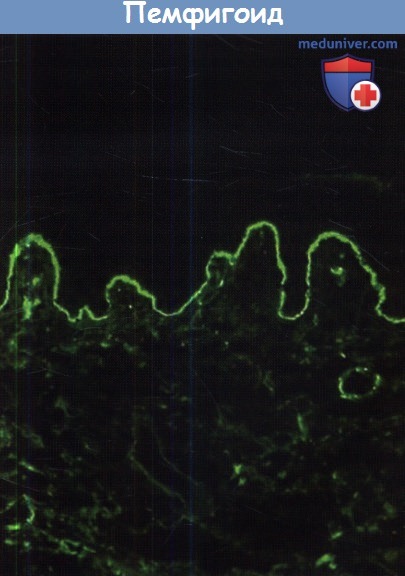
содержащей аутоантитела к коллагену XVII.
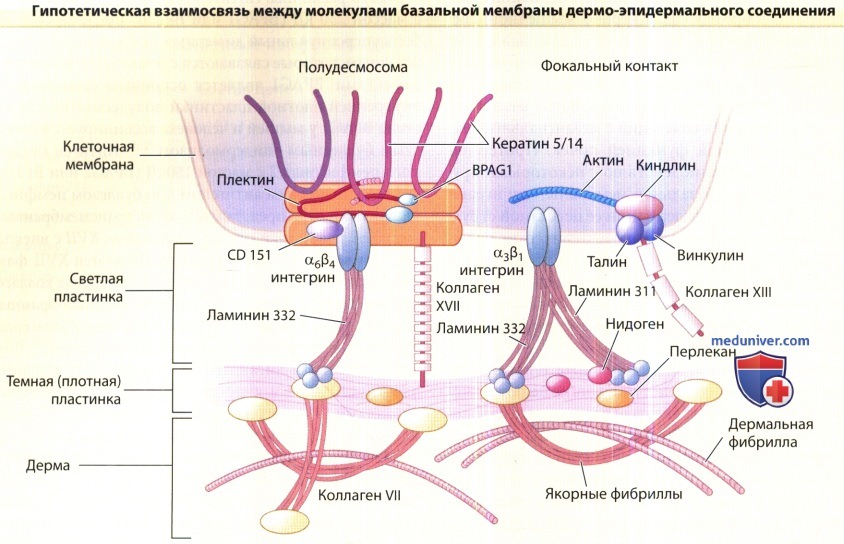
На рисунке ламинин-332 представлен в виде мостика между трансмембранным интегрином полудесмосомы α6β4 и доменом NC-1 коллагена VII.
Сильная связь ламинина-332 с а6β4 и с коллагеном VII обеспечивает первичную устойчивость к воздействию сил трения.
Ее также поддерживает трансмембранный коллаген XVII, так как и его внеклеточный домен связывает ламинин-332.
В эпителиальной клетке трансмембранные элементы связывают белки плотной пластинки полудесмосом, антиген буллезного пемфигоида (BPAG) 1 и плектин, которые затем соединяются с кератинами.
Коллаген VII связывает BPAG1, интегрин α6β4 и плектин, а интегрин α6β4 вступает в связь с плектином.
Комплекс ламининов 5-6 изображен в базальной мембране между полудесмосомами, он связан интегрином α3β1 и соединен с внутриклеточными белками киндлином, талином и винкулином.
По всей вероятности, данный комплекс поддерживает устойчивость базальной мембраны.
In vitro интегрин α3β1, киндлин, талин, винкулин, а также другой трансмембранный коллаген типа XIII расположены в фокальных контактах, которые могут служить связующим звеном между базальной мембраной и сетью кортикального актина эпителия.
В темной пластинке (lamina densa) сети коллагена IV и перлекана стабилизируются нидогеном. Якорные фибриллы прикрепляются к темной пластинке посредством домена NC-1 коллагена VII.
Фибриллы проникают в дерму и либо оканчиваются в якорной пластинке, либо, образуя петлю, возвращаются назад в темную пластинку.
Сеть якорных фибрилл захватывает дермальные фибриллы, обеспечивая адгезию темной пластинки (lamina densa) к сосочковому слою дермы. В изображении молекул масштаб не соблюден.
- Рекомендуем далее ознакомиться со статьей "Строение якорных филаментов и их функции"
Оглавление темы "Базальная мембрана.":- Эпидермальная адгезия и строение десмосом
- Строение белков десмосом и их функции
- Строение базальной мембраны и ее функции
- Строение дермо-эпидермального соединения кожи
- Состав базальной мембраны и ее биохимия
- Строение полудесмосом базальной мембраны и их функции
- Строение якорных филаментов и их функции
- Строение плотной пластины эпителия (lamina densa) и ее функции
- Строение якорных фибрилл и их функции
- Клетки участвующие в образовании базальной мембраны

