Болезни внеклеточного матрикса (ВКМ) дермы
Многие компоненты внеклеточного матрикса дермы (ВКМ) в дермальном компартменте кожи отличаются многоступенчатыми процессами биосинтеза, созревания и клеточного обмена, часто имеют комплексную структуру и собираются в исключительно сложные сети. Поэтому неудивительно, что в результате нарушений в экспрессии генов, структуре, гомеостазе и сборке белков внеклеточного матрикса дермы (ВКМ) развиваются многочисленные заболевания.
Исходя из современного понимания молекулярной биологии и метаболизма компонентов внеклеточного матрикса (ВКМ), можно идентифицировать отдельные точки, в которых возникают дефекты. Дефекты могут находиться на различных уровнях. Идентифицированы многие мутации в генах, кодирующих белки ВКМ, или в ферментах, участвующих в их посттрансляционных модификациях или супрамолекулярных сборках; эти данные обсуждались в предыдущих параграфах. Процессы отложения и сборки ВКМ в нерастворимые комплексные полимеры являются строго контролируемыми механизмами, которые подвергаются существенным изменениям в процессе развития, ремоделирования тканей, репарации, старения, заживления ран и фиброза. Несколько белков ВКМ являются также мишенями для циркулирующих антител, что приводит к аутоиммунным заболеваниям.
Наиболее интересными с точки зрения дерматологии являются аутоиммунные пузырные заболевания, которые подробно обсуждаются в других главах. Также появляется все больше данных о том, что многие белки ВКМ обладают регулирующими функциями, при нарушении которых развиваются болезнетворные процессы.

а) Кожные коллагенозы. Термин «коллагеноз» применяется для обозначения клинического состояния, при котором отмечаются аномалии в структуре, синтезе или распаде коллагена. Этот термин часто используется для описания клинически гетерогенной группы воспалительных заболеваний, включая красную волчанку, склеродермию и дерматомиозит. В классической номенклатуре, применение термина «коллагеноз» к этим заболеваниям обосновано морфологическими изменениями, известными как фибриноидная дегенерация, которая интерпретируется как изменения в коллагеновых волокнах. Однако в настоящее время нет убедительных свидетельств о первичном дефекте коллагена при этих заболеваниях. На основании имеющихся биохимических данных единственным клиническим состоянием среди классических коллагенозов, при котором нарушается регулировка метаболизма коллагена, является склеродермия.
Коллаген во многих аспектах является необычным белком, и его структура и метаболизм имеют ряд особых признаков, важных для накопления нормальных коллагеновых волокон. При первичном коллагенозе дефект может быть наследственной аномалией в структуре коллагена или проколлагена или в ферментах, участвующих в биосинтезе и деградации коллагена. Действительно, имеется много заболеваний, при которых описан базовый биохимический дефект в структуре коллагена, и несколько наследственных заболеваний соединительной ткани с поражениями кожи, которые, как теперь известно, развились вследствие специфических молекулярных дефектов в генах коллагена. Для многих таких заболеваний характерны вставки, делеции или одиночные нуклеотидные замещения в генах, которые изменяют первичную структуру белка. При некоторых приобретенных заболеваниях нарушена регулировка экспрессии генов коллагена, что приводит к нарушениям в накоплении коллагена в тканях. Разнообразие патологий коллагена видно на примере синдрома Элерса-Данло и фиброзных заболеваний кожи.
Синдром Элерса-Данло объединяет группу фенотипически похожих заболеваний, которые часто развиваются вследствие аномалий в структуре коллагена или в ферментах, модифицирующих молекулы коллагена. Фиброзные заболевания кожи, наоборот, являются примером состояний, при которых нарушена регулировка экспрессии генов коллагена, что приводит к избыточному скоплению коллагена в тканях.
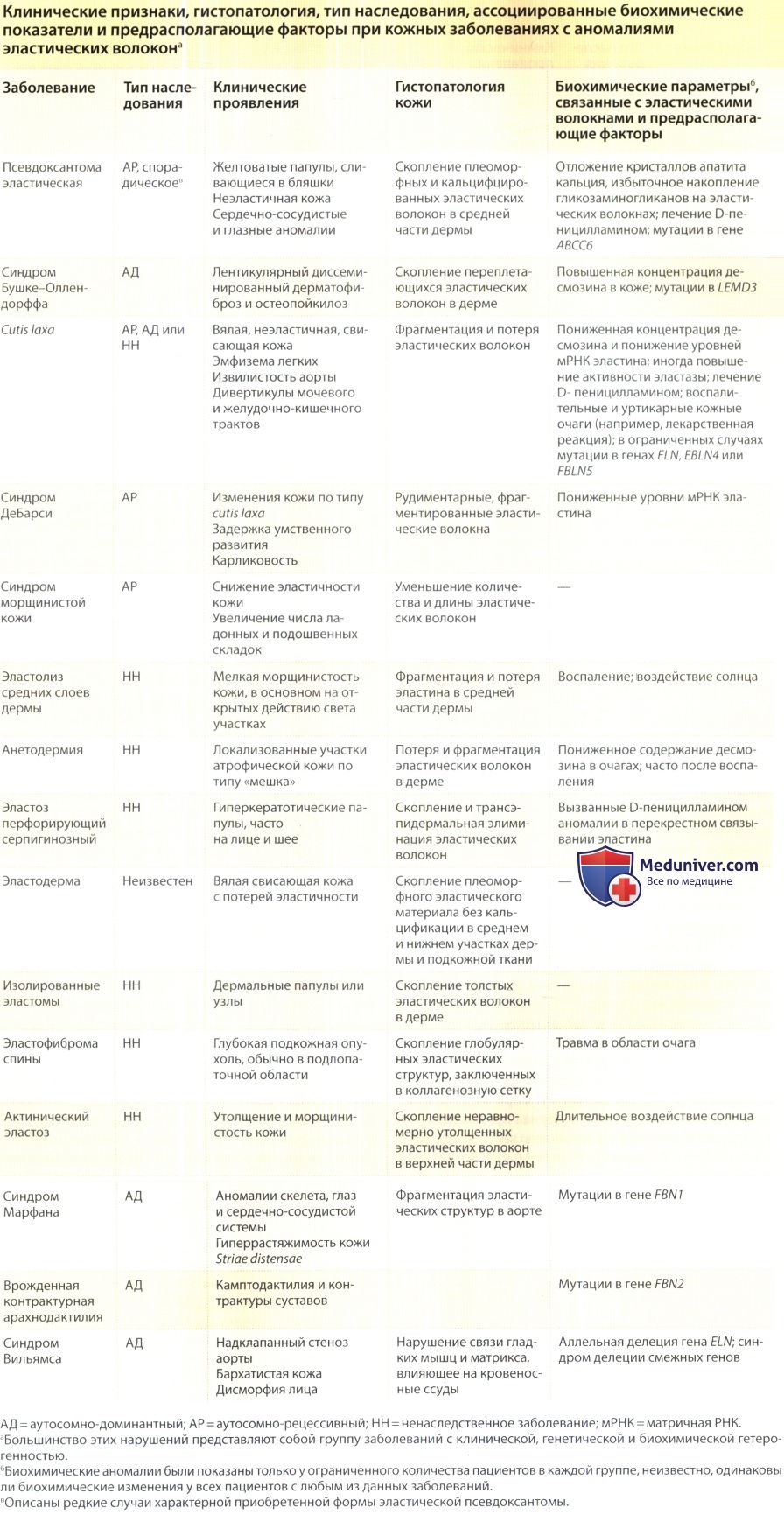
б) Патология эластических волокон при кожных заболеваниях. Было показано, что некоторые наследственные и приобретенные заболевания соединительной ткани связаны с аномалиями в эластических волокнах, в том числе эластическая псевдоксантома (pseudoxanthoma elasticum), вялая кожа (cutis laxa) и синдром Бушке-Оллендорфф. Кроме того, выделяются клинически характерные патологии с фенотипами, близко напоминающими эластическую псевдоксантому (например, эластодермия) или вялую кожу (например, синдром морщинистой кожи).
В последнее время был достигнут значительный прогресс в идентификации и объяснении молекулярных механизмов, связанных с мутациями в генах фибриллина. Гетерозиготные мутации, которые влияют на структуру или приводят к пониженному синтезу фибриллина, являются причиной синдрома Марфана. Клинически это заболевание характеризуется аномалиями и нарушениями в органе зрения, скелетной и сердечно-сосудистой системах у пациентов наблюдается тонкая кожа с выраженными полосами натяжения; у некоторых, однако, отмечаются контрактуры.
Тщательный анализ мышиных моделей с похожими молекулярными дефектами выявил, что мутации в гене фибриллина ассоциируются с усиленной TGF-β-сигнализацией. Интересно отметить, что в случае фенотипа с развитием пролапса митрального клапана у мышей развитие дефекта можно приостановить или замедлить добавлением антител, нейтрализующих TGF-β. Эти данные указывают на вероятное участие фибриллина-1 в регулировке активности TGF-β. В клиническом исследовании применение ингибиторов ангиотензина II у пациентов с синдромом Марфана стабильно и значительно замедляло прогрессирование дилатации корня аорты.
в) Болезни из-за аномалий в метаболизме протеогликана. Многие кожные заболевания ассоциируются с аномалиями синтеза или накопления протеогликанов. Дефицит стержневого белка декорина является причиной одного из вариантов синдрома Элерса-Данло. Экспрессия протеогликана влияет даже на инфекционные заболевания. Хорошим примером являются мыши с дефицитом декорина, которые довольно устойчивы к инфекции Borrelia burgdorferi. Такая устойчивость предположительно вызвана частичной зависимостью возбудителя от наличия декорина для связывания в дерме. С возрастом состав GAG в коже подвергается выраженным изменениям, и предполагается, что наблюдаемое при этом понижение содержания гиалуроновой кислоты вызывает ослабление кожного тургора.
Ретиноиды также влияют на эту реакцию. В келоидах синтез гиалуроновой кислоты повышен. Тиреоидный гормон тоже оказывает выраженное действие на синтез протеогликанов и GAG. Проявления этого влияния наблюдаются при тиреоидной дермопатии, при которой накапливающийся муцинозный материал представляет собой преимущественно гиалуроновую кислоту и хондроитинсульфат. Сообщалось об аномальных количествах протеогликанов при других патологических состояниях кожи, в том числе эластической псевдоксантоме, склеродермии, псориазе, варианте синдрома Элерса-Данло, микседематозном лихене, а также в коже, облученной ультрафиолетом В. Данные факты не предполагают, однако, что причиной этих заболеваний является аномальный метаболизм протеогликанов, но указывают, что на патофизиологию кожного заболевания в большой мере влияет функционирование протеогликанов кожи.
г) Выяснение патологических механизмов. Мутации в генах, кодирующих ключевые белки ВКМ, часто приводят к функциональным нарушениям, которые ассоциируются с тяжелыми клиническими симптомами. Хотя структурными изменениями можно, конечно, объяснить ряд симптомов, очевидно, что не все плеотропные клинические изменения возникают непосредственно и исключительно вследствие аномалий в структуре белков. Накапливается все больше данных, свидетельствующих о том, что индукция стресса эндоплазматической сети представляет собой дополнительный механизм, объясняющий некоторые из опасных эффектов, возникающих вследствие мутаций в генах, необходимых для выработки белков ВКМ. Например, накопление неправильно уложенных или неуложенных мутантных полипептидов в эндоплазматической сети вызывает так называемую «реакцию неуложенного белка».
Она приводит к вредным процессам различной степени тяжести в диапазоне от усиленной нацеленности белка на протеосому для распада, аутофагии, уменьшения общего белкового синтеза, в том числе аномального белка, до полной клеточной дисфункции с апоптозом клеток. Такой вредоносный результат был показан для мутаций в нескольких генах ВКМ, часто приводящих к тяжелым клиническим проявлениям несовершенного остеогенеза или некоторых наследственных заболеваний хрящевой ткани. Однако предстоит еще установить, могут ли эти механизмы играть более широкую роль и применяться к другим наследственным или приобретенным заболеваниям ВКМ.
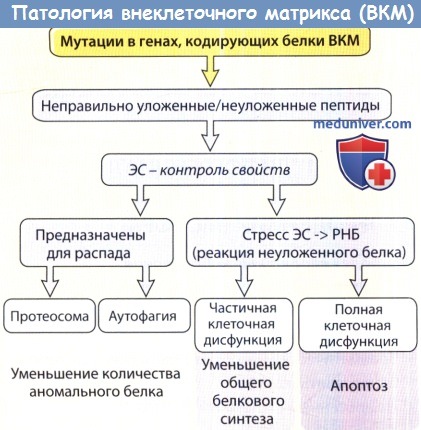
Появление неправильно уложенных полипептидных цепей ВКМ или излишне развернутых полипептидов вызывает либо их распад,
либо (при накоплении в эндоплазматической сети) так называемую «реакцию неуложенного белка», ведущие к частичной или полной клеточной дисфункции и апоптозу.
- Рекомендуем далее ознакомиться со статьей "Причины и механизмы развития морфеа (локализованной склеродермии)"
Оглавление темы "Внеклеточный матрикс (ВКМ) дермы.":
