Роль нарушений обмена аминокислот в патогенезе атаксии Фридрейха
Определенную роль в патогенезе атаксии Фридрейха может играть нарушение гомеостаза глутатиона — естественного антиоксиданта, защищающего клетку от активных форм кислорода. Дефекты глутатиона являются как причиной, так и следствием окислительного стресса при нейродегенеративных заболеваниях (Beal М., Schulz J. et al., Schapira A.).
В экспериментах на клеточных линиях, полученных от больных атаксией Фридрейха, обнаружено, что в результате железоиндуцированного накопления активных форм кислорода при атаксии Фридрейха происходит глутатионизация белка актина. Этот процесс приводит к нарушению организации микрофиламентов в фибробластах и значительному повышению коэффициента «связанный/свободный глутатион» (Pastore A. et al.).
Важной находкой при изучении фратаксин-дефицитных клеток человека стало выявление сниженного уровня экспрессии генов, участвующих в метаболизме серосодержащих аминокислот — гомоцистеина, цистеина и серина. Их уровни были значительно снижены как в митохондриальных, так и в клеточных фракциях (Tan G.).
Более того, в последние годы показана значительная роль в патогенезе болезни развивающегося дефицита семейства Fe-S-содержащих белков — особого класса электронпереносящих энзимов, содержащих железо и серу в лабильной форме в составе кластера с тетраэдрической геометрией (Rotig A. et al.). Указанные белки участвуют во многих биохимических процессах, в том числе в энергетическом метаболизме.
В результате «несостоятельности» железа, его неспособности инкорпорироваться в Fe-S-кластеры и их дестабилизации при атаксии Фридрейха нарушаются многочисленные функции этих белков (окислительное фосфорилирование, метаболизм аминокислот и др.). Патогенетически значимыми в данном случае являются прежде всего ферменты комплексов I—III дыхательной цепи митохондрий и аконитаза — Fe-S-содержащий белок, участвующий в гомеостазе железа.
Известно, что Fe-S-белки (в том числе аконитаза) чрезвычайно чувствительны к повреждающему действию свободных радикалов. При атаксии Фридрейха в результате исследования биоптатов миокарда выявлены выраженные дефекты комплексов I—III дыхательной цепи митохондрий, содержащих Fc-S-кластеры, а также 10-кратное снижение активности цитозольной и митохондриальной фракций аконитазы (Rotig A. et al., Bradley J. et al.).
Поскольку комплекс II кодируется ядерными генами, такая комбинированная недостаточность активности комплексов I-III и аконитазы не может быть объяснена мутациями митохондриальной ДНК, что подтверждается отсутствием данных о реорганизации митохондриального генома в кардиомиоцитах, скелетных мышцах и лимфоцитах больных атаксией Фридрейха (Rotig A. et al.).
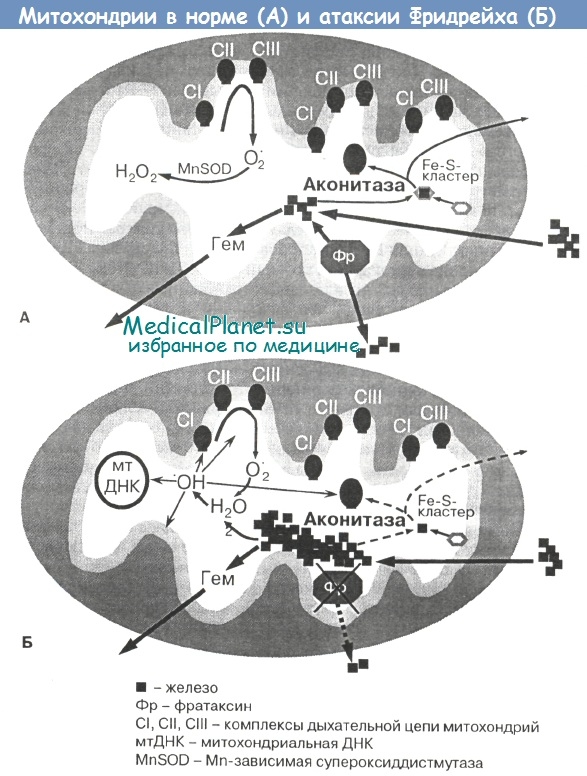
Интересно также отметить, что у больных с кардиомиопатиями, возникшими в результате мутаций митохондриальной ДНК, активность Fe-S-coдсржащих белков остается в пределах нормы; это ешс раз подтверждает, что инактивация Fc-S-кластеров специфично связана с дефицитом фратаксина в миокарде и, по-видимому, в UHC (Rotig A. et al.). Более поздние работы на моделях трансгенных фратаксин-дефицитных мышей показали, что фратаксин играет критическую роль на самых ранних этапах биосинтеза и сборки Fc-S-кластеров, хотя и не является их составной частью (Seznec Н. et al.).
Таким образом, имеются два основных независимых друг от друга механизма клеточной токсичности при атаксии Фридрейха — окислительный стресс и дефицит Fe-S-содержащих белков. Вероятно, уменьшение активности комплексов дыхательной цепи является следствием митохондриальной аккумуляции железа, тогда как уменьшение активности аконитазы непосредственно связано со снижением уровня фратаксина.
С другой стороны, утрата активности цитозольной фракции аконитазы может также быть отражением снижения содержания цитозольного железа, так как аконитаза в цитозоле клетки конвертируется, как было сказано выше, в Fe-зависимый белок IRE-BPI в ответ на низкую концентрацию железа (Kaptain S. et al.). В свете имеющихся данных Fe-S-белки могут рассматриваться в качестве критических «молекулярных мишеней» при атаксии Фридрейха (Puccio Н. et al., Pandolfo М., Wilson R.).
У больных формируется своеобразный порочный круг: окислительный стресс непосредственно вызывает недостаточность Fc-S-белков, а высвобождающееся при этом железо, в свою очередь, усиливает уже существующую перегрузку железом. Не вполне ясным остается вопрос о том, первичным или вторичным является дефицит Fc-S-бслков по отношению к аккумуляции железа в митохондриальном матриксе.
Несмотря на предполагаемую «поглотительную» функцию фратаксина в отношении железа, в работе G.Musco и соавт. было четко показано, что фратаксин не содержит высокоаффинных Fe-связывающих центров. Кроме того, теми же авторами на основании проведенных экспериментов был сделан вывод, что фратаксин не способен к агрегации, подобно ферритину, в ответ на избыточное содержание железа. Возможно, фратаксин функционирует в клетке как переносчик какого-либо антиоксиданта (такого, например, как а-токоферол или глутатион).
Высказывается также предположение, что фратаксин может участвовать в импорте белков или их процессинге в качестве молекулярного шаперона. Дальнейшее изучение белков, взаимодействующих с фратаксином, поможет более точно выяснить его роль в контроле митохондриального метаболизма железа, а также в биогенезе и функционировании Fe-S-содержащих белков клетки.
Возможные молекулярные механизмы атаксии Фридрейха, связанные с недостаточностью фратаксина, показаны на рисунке выше.
- Читать "Диагностика атаксии Фридрейха путем оценки митохондриальных нарушений"
Оглавление темы "Атаксия Фридрейха":- Лечение и профилактика врожденных мозжечковых атаксий
- Атаксия Фридрейха - история изучения
- Генетика атаксии Фридрейха
- Клинико-генетические корреляции при атаксии Фридрейха
- Фратаксин - функции, значение. Патогенез атаксии Фридрейха
- Роль патологии митохондрий в патогенезе атаксии Фридрейха
- Роль нарушений обмена аминокислот в патогенезе атаксии Фридрейха
- Диагностика атаксии Фридрейха путем оценки митохондриальных нарушений
- Цитохимический анализ активности митохондриальных ферментов при атаксии Фридрейха
- Морфометрический анализ активности митохондриальных ферментов при атаксии Фридрейха

