Болезнь ионных каналов. Характеристика болезни ионных каналов.
В последнее десятилетие описан ряд заболеваний, возникновение которых обусловлено мутациями в генах белковых субъединиц натриевых, калиевых, кальциевых и хлорных ионных каналов. Эта группа заболеваний получила название болезни ионных каналов (БИК). Наибольшее количество нозологических форм представлено наследственными болезнями нервной системы с аутосомно-доминантным типом наследования, при которых нарушаются механизмы проницаемости и возбудимости клеточных мембран мышечного волокна или нейронов. Нарушение функционирования ионных каналов в мембране мышечного волокна приводит к появлению клинических симптомов периодического паралича и миотоний, а патология этих каналов в мембране нервных клеток обусловливает появление различных вариантов наследственных эпилепсии и атаксий.
Все вольтаж-зависимые ионные каналы имеют эволюционное родство и сходную структуру. Они состоят из шести трансмембранных сегментов, связанных экстрацеллюлярной и интрацеллюлярной петлями и формирующих один домен. Четвертый трансмембранный сегмент каждого домена содержит несколько положительно заряженных аминокислот, которые чувствительны к градиенту напряжения на мембране. Другой критический регион представлен погруженной в мембрану экстрацеллюлярной петлей между пятым и шестым сегментом. Согласованное действие этих петель всех четырех доменов формирует пору ионного канала. Аминокислоты этих петель детерминируют селективное проникновение через канал только определенных ионов. В калиевых каналах присутствует один такой домен, а в кальциевых и натриевых каналах четыре домена формируют одну а-субъединицу.
Схема строения натриевого канала мышечной мембраны представлена на рисунке.
Натриевый канал содержит две субъединицы — а и р. а-Субъедипица состоит из четырех повторяющихся доменов, связанных как с экстрацеллюлярным, так и с ннтрацеллюлярным матриксом. Каждый домен в свою очередь, подразделен на шесть трансмембранных сегментов. Четвертый сегмент каждого домена содержит несколько положительно заряженных аминокислот, которые чувствительны к градиенту потенциала на мембране мышечного волокна. Другой критической областью натриевого канала является участок между 5- и 6-ым сегментом, где находится пора канала с избирательной проницаемостью для отдельных ионов. Нарушение в работе ионных каналов может быть основой наследственного заболевания. Впервые это было показано Фонтейном с соавт. в 1990 году: оказалось, что периодический гиперкалиемический паралич коррелирует с неправильным функционированием натриевых каналов.
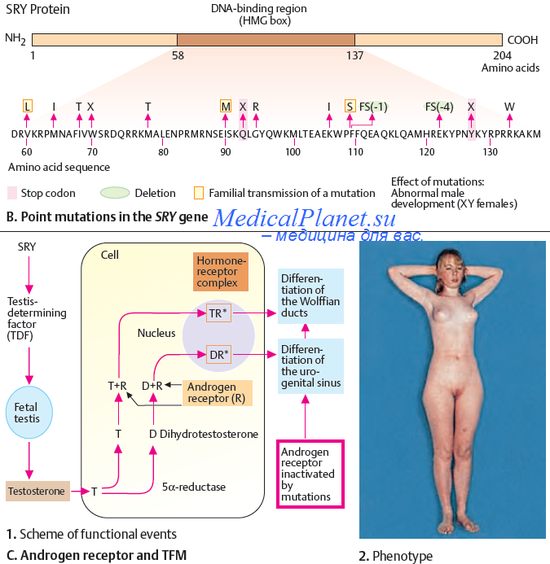
Наиболее изучена группа заболеваний, обусловленных нарушением функционирования именно натриевых каналов.
Помимо гиперкалиемического периодического паралича, она включает несколько нозологических форм: врожденную парамиотонию Эйленбурга, ацетазол-зависимую миотонию и врожденную миастению. Для всех заболеваний этой группы характерен приступообразный характер течения. Рассмотрим более подробно гиперкалиемический периодический паралич.
Периодический гиперкалиемический паралич (ОМШ: 170500). Заболевание впервые описано И. Гамсторпом в 1956 г. Его этиологическим фактором являются мутации, нарушающие функционирование гена SCN4A. Ген картирован на хромосоме 17q23.1-q.25.3 и кодирует белок а-субъединицы натриевого канала, состоящий из 1836 аминокислот. Основной тип мутаций — точковые однонуклеотидные замены, обусловливающие аномалии во 2-ом и 4-ом доменах белка. Патогенетический механизм заболевания заключается в инактивации натриевых каналов скелетных мышц, в результате чего ионы натрия продолжают просачиваться внутрь мышечного волокна. В норме натрий попадает в мышечное волокно после деполяризации мембраны, которая приводит к быстрому открытию натриевого канала из-за конформационных изменений вольтаж-зависимого 4-го сегмента.
Натриевый поток устремляется внутрь волокна, а поток ионов калия движется в противоположном направлении — в межклеточное пространство, обусловливая состояние гиперкалиемии. Прохождение натрия в|гутрь мембраны сочетается с нарастанием амплитуды потенциала действия и быстрым закрытием канала даже при персистировании процесса деполяризации.
В интактных мышцах инактивация канала наступает после падения амплитуды потенциала действия. Выход канала из стадии инактивации происходит только после наступления реполяризации мембраны.
В результате мутации в гене нарушается функционирование а-субъедипипы натриевого канала, потенциал действия пролонгируется и нарушается процесс реполяризации мембраны мышечного волокна. Умеренная деполяризация мембраны (от 5 до 20 мв) обусловливает миотонию, а выраженная деполяризация (более 20 мв) приводит к возникновению мышечной слабости. Этапы патогенеза заболевания представляются следующим образом: увеличение концентрации внеклеточного калия -> деполяризация мембраны мышечного волокна -> открытие натриевых каналов —> персистирование внутриклеточного потока натрия и внеклеточного потока калия -> поддержание деполяризации мышечной мембраны -> инактивация нормальных натриевых каналов -> снижение электрической возбудимости мышечной мембраны.
Первые признаки заболевания возникают в возрасте от 5 до 20 лет и характеризуются приступами выраженной мышечной слабости и адинамии, в течение которых больные теряют способность двигаться. Характерная особенность этой формы пароксизмальной миоплегии - повышение уровня калия в сыворотке крови и экскреция его с мочой во время приступа и снижение уровня натрия. В большинстве случаев приступы возникают днем и провоцируются голоданием, употреблением в пишу продуктов богатых калием, а также лекарственных препаратов, содержащих калий, физическими нагрузками и переохлаждением. Выделяют три типа паралича: в комбинации с миотонией, без миотонии и с признаками парамиотонии. Зачастую возникновению приступа предшествуют парестезии в области лица и листальных отделов конечностей. Сухожильные рефлексы во время приступа отсутствуют. У большинства больных приступ сопровождается выраженными вегетативными нарушениями — артериальной гипертензией, потливостью, тахикардией, аритмиями.
Изменения со стороны сердечно-сосудистой системы могут достигать значительной выраженности и даже приводить к внезапной смерти. После окончания приступа у ряда больных отмечается болезненность мышц и усиленный диурез. По мере развития заболевания, особенно у больных в возрасте старше 40 лет, частота и выраженность приступов уменьшается. Диагностика заболевания осуществляется на основании клинической картины, определения уровня калия в крови во время приступа, а также в результате проведения молекулярно-генетического анализа, направленного на обнаружение мутаций в гене SCN4A. Для данного заболевания возможна дородовая ДНК-диагностика.
- Читать далее "Коллагенопатии. Признаки и диагностика коллагенопатий."
Оглавление темы "Болезни с менделирующим типом наследования.":1. Генетическая гетерогенность. Клиника моногенных болезней.
2. Патогенез моногенных заболеваний. Механизмы развития моногенных болезней.
3. Болезнь Шарко-Мари-Тута. Наследственная мотосенсорная нейропатия.
4. Болезнь ионных каналов. Характеристика болезни ионных каналов.
5. Коллагенопатии. Признаки и диагностика коллагенопатий.
6. Аутосомно-рецессивный тип наследования. Характеристика аутосомно-рецессивных заболеваний.
7. Муковисцидоз. Кистозный фиброз. Диагностика муковисцидоза.
8. Проксимальная спинальная амиотрофия. Болезнь Вердниг—Гофмана.
9. Нарушения половой дифференцировки. Адреногенитальный синдром.
10. Мужские нарушения половой дифференцировки. Синдром персистенции мюллеровых протоков.

