Иммунологическая толерантность и ее механизмы
Иммунологическая толерантность представляет собой феномен устойчивости к антигену в результате воздействия этого антигена на лимфоциты. Термин аутотолерантность означает отсутствие реактивности к аутоантигенам организма, и это определяет его способность жить в согласии со своими клетками и тканями.
Лимфоциты, несущие рецепторы, способные распознавать аутоантигены, образуются постоянно, и эти клетки должны быть элиминированы или инактивированы, как только они распознают антигены, чтобы предупредить их патогенное действие. Аутотолерантность можно классифицировать как центральную и периферическую. Рассмотрим кратко каждую из них.
а) Центральная толерантность. Клоны незрелых аутореактивных Т- и В-лимфоцитов, распознающие аутоантигены во время своего созревания в центральных (или генеративных) лимфоидных органах (тимус — для Т-клеток и костный мозг — для В-клеток), уничтожаются или инактивируются. Механизмы центральной толерантности Т- и В-клеток имеют как сходство, так и различия:
- у созревающих Т-клеток в результате происходящей случайным образом соматической перестройки генов образуются разнообразные TCR. Вследствие независимого от антигена образования TCR появляются многие лимфоциты, экспрессирующие высокоаффинные рецепторы для аутоантигенов. Незрелые лимфоциты, взаимодействуя с антигенами в тимусе, погибают по механизму апоптоза.
Этот процесс, называемый отрицательной селекцией или делецией, отвечает за элиминацию многих аутореактивных лимфоцитов из пула Т-клеток. Множество разнообразных аутологичных белковых антигенов, включая антигены, которые предположительно присутствуют только в периферических тканях, процессируются и презентируются тимусными антигенпрезентирующими клетками в ассоциации с собственными молекулами МНС и, следовательно, могут быть распознаны потенциально аутореактивными Т-клетками.
Белок AIRE (аутоиммунный регулятор) стимулирует экспрессию некоторых ограниченных периферическими тканями аутоантигенов в тимусе, поэтому играет важную роль в делеции незрелых Т-клеток, специфических для этих антигенов. Мутации в гене AIRE служат причиной аутоиммунной полиэндокринопатии. Некоторые из Т-клеток CD4+, которые распознают в тимусе аутоантигены, но не погибают, превращаются в регуляторные Т-клетки;
- когда созревающие В-клетки активно распознают аутоантигены в костном мозге, у многих из них реактивируется механизм перестройки генов антигенных рецепторов, и эти В-клетки начинают экспрессировать новые антигенные рецепторы, неспецифические для аутоантигенов. Этот процесс называют редактированием рецепторов. Вычислено, что от 25 до 50% всех В-клеток в организме подвергаются ему во время созревания.
Если этого процесса не происходит, аутореактивные клетки гибнут путем апоптоза и потенциально опасные лимфоциты выбывают из пула зрелых клеток.
Однако центральная толерантность представляет собой далеко не совершенный механизм. Не все аутоантигены могут присутствовать в тимусе, поэтому Т-клетки, несущие рецепторы к таким аутоантигенам, «проскальзывают» на периферию. Подобный процесс существует и в В-клеточной системе. Аутореактивные лимфоциты, избегают отрицательной селекции, способны вызывать повреждение тканей, если не делегируются или инактивируются в периферических тканях.
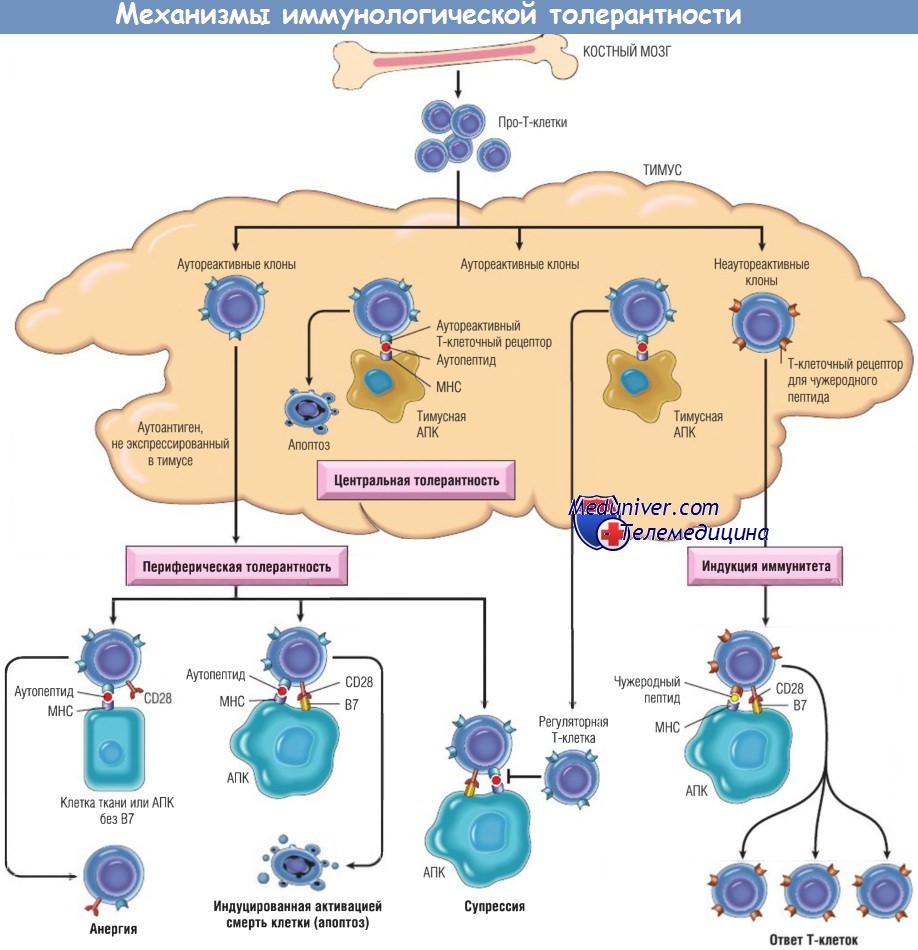
Схематическое изображение механизмов центральной и периферической толерантности Т-клеток CD4+ к аутоантигенам.
МНС — главный комплекс гистосовместимости; АПК — антигенпрезентирующая клетка.
б) Периферическая толерантность. Существует несколько механизмов подавления потенциально аутореактивных Т- и В-клеток в периферических тканях (лучше всего эти механизмы изучены в отношении Т-клеток).
- Анергия. Этот термин означает длительную или необратимую инактивацию функций лимфоцитов, индуцированных взаимодействием с антигеном при некоторых условиях. Для активации антигенспецифических Т-клеток необходимы два сигнала: распознавание пептидного антигена в ассоциации с собственными молекулами МНС на поверхности АПК и серия костимулирующих сигналов (сигналов 2), посылаемых АПК. Костимулирующие сигналы генерируют некоторые ассоциированные с Т-клетками молекулы, такие как CD28, связывающиеся со своими лигандами (костимуляторы В7-1 и В7-2) на АПК.
Если антиген презентирован клетками, лишенными кости-муляторов, сигнал становится отрицательным, а клетка — анергичной. Поскольку в нормальных тканях костимулирующие молекулы не экспрессируются или слабо экспрессируются покоящимися дендритными клетками, взаимодействие между аутореактивными Т-клетками и специфическими для них аутоантигенами, презентированными этими дендритными клетками, может привести к анергии. В различных экспериментальных системах было обнаружено два механизма Т-клеточной анергии.
Во-первых, клетки утрачивают способность индуцировать биохимические сигналы, идущие из TCR-комплекса, частично по причине активации убиквитин-лигаз и протеолитического расщепления ассоциированных с рецептором сигнальных белков. Во-вторых, Т-клетки, распознающие аутоантигены, получают ингибирующий сигнал от рецепторов, структурно гомологичных CD28, но выполняющих противоположные функции. Два из этих ингибирующих рецепторов — это CTLA-4, который (подобно CD28) также связывается с молекулами В7, и PD-1, взаимодействующий с двумя лигандами, экспрессируемыми разнообразными клетками.
Каким образом Т-клетки «выбирают» CD28, чтобы распознать В7 и активироваться, или CTLA-4, чтобы распознать В7 и стать анергичными, — вопрос, на который ответ еще не получен.
Тем не менее значение этих ингибирующих механизмов показано в экспериментах на мышах с нокаутным геном, кодирующим CTLA-4 или PD-1. У таких животных развиваются аутоиммунные заболевания. Полиморфизм CTLA-4 ассоциирован с определенными аутоиммунными эндокринными расстройствами у человека. Интересно отметить, что некоторые опухоли и вирусы способны использовать те же самые способы иммунной регуляции, чтобы избежать иммунной атаки.
Анергия возникает также у В-клеток в периферических тканях. Считают, что В-клетки, взаимодействуя с аутоантигеном на периферии, особенно в отсутствие специфических хелперных Т-клеток, становятся неспособными отвечать на последующую антигенную стимуляцию и могут быть элиминированы из лимфоидных фолликулов, что приводит к смерти В-клеток.
- Супрессивное действие регуляторных Т-клеток. Популяция Т-клеток, называемых регуляторными Т-клетками, играет важную роль в предотвращении иммунных реакций против аутоантигенов. Регуляторные Т-клетки развиваются главным образом в тимусе в результате распознавания аутоантигенов, однако могут быть индуцированы и в периферических лимфоидных тканях. Из регуляторных Т-клеток лучше всего охарактеризованы лимфоциты CD4+, конститутивно экспрессирующие молекулу CD25, a-цепь рецептора IL-2, и фактор транскрипции семейства forkhead («вильчатая головка»), называемый Foxp3. И IL-2, и Foxp3 необходимы для развития и сохранения функциональных регуляторных Т-клеток CD4+.
Мутации в гене Fохр3 приводят к развитию тяжелого аутоиммунитета у человека и мыши. У людей эти мутации служат причиной системного аутоиммунного заболевания, называемого IPEX (иммунное дерегулирование, полиэндокри-нопатия, энтеропатия, сцепленные с Х-хромосомой заболевания). У мышей, нокаутных по генам, кодирующим либо IL-2, либо а- или b-цепи рецептора IL-2, также развивается тяжелый полиорганный аутоиммунитет, поскольку IL-2 необходим для сохранения регуляторных Т-клеток. Исследование геномных ассоциаций выявило, что полиморфизм гена CD25 ассоциирован с рассеянным склерозом и другими аутоиммунными болезнями, поэтому не исключено, что дефект регуляторных Т-клеток способствует развитию этих заболеваний. Механизмы, посредством которых регуляторные Т-клетки супрессируют иммунный ответ, выяснены не полностью.
Ингибирующее действие этих клеток может быть обусловлено секрецией иммуносупрессивных цитокинов, таких как IL-10 и TGF-(3, подавляющих активацию и эффекторные функции лимфоцитов.
- Делеция в результате смерти клеток, индуцированной активацией. Т-клетки CD4+, распознающие аутоантигены, могут получить сигналы, способствующие смерти клеток в результате апоптоза. Этот процесс получил название смерть клеток, индуцированная активацией, т.к. он является следствием активации Т-клеток. На основании данных, полученных в экспериментах на мышах, предложены два механизма этого феномена.
Установлено, что после распознавания аутоантигенов Т-клетки могут экспрессировать Bim (проапоптозный член семейства Bel) без сопутствующей экспрессии антиапоптозных членов семейства, Вс1-2 и Bcl-х (для их индукции нужен полный набор сигналов для активации лимфоцитов). В отсутствие их экспрессии Bim инициирует апоптоз по внутреннему (митохондриальному) пути. Второй механизм смерти Т-клеток CD4+ и В-клеток, индуцированных активацией, связан с системой Fas-FasL. Лимфоциты, как и многие другие клетки, экспрессируют Fas (CD95), член семейства рецептора TNF. FasL, мембранный белок, структурно гомологичный TNF, экспрессируется главным образом активированными Т-лимфоцитами.
Взаимодействие Fas и FasL индуцирует апоптоз активированных Т-клеток. Установлено, что, если аутоантигены связываются с антигенными рецепторами Т-клеток, специфических для аутоантигенов, Fas и FasL коэкспрессируются, приводя к элиминации клеток путем апоптоза, опосредованного Fas. Аутореактивные В-клетки также могут подвергаться делеции посредством FasL Т-клеток, взаимодействующего с Fas В-клеток. Значение этого механизма в периферической делеции аутореактивных лимфоцитов подтверждается данными экспериментов на мышах, естественных мутантах по Fas или FasL. У животных обеих линий развивается аутоиммунное заболевание, напоминающее СКВ у человека, ассоциированное с генерализованной лимфопролиферацией. У человека подобное заболевание обусловлено мутациями гена FAS и получило название аутоиммунного лимфопролиферативного синдрома.
Некоторые антигены секвестрированы (скрыты) от иммунной системы, т.к. ткани органов, в которых локализуются антигены, не сообщаются с кровью или лимфой. Эти аутоантигены не индуцируют толерантности, но и не вызывают иммунного ответа и по существу «игнорируются» иммунной системой. К таким органам относятся яички, глаза и головной мозг. Эти органы называют иммунологически привилегированными областями, поскольку трудно индуцировать иммунный ответ, вводя в них антиген. Однако если антигены высвобождаются из этих тканей, например вследствие травмы или инфекции, возможен иммунный ответ, приводящий к длительному воспалению тканей и их повреждению. Так происходит при посттравматическом орхите и увеите.
- Рекомендуем ознакомиться со следующей статьей "Патогенез (механизм) аутоиммунитета"
Оглавление темы "Аутоиммунные болезни":- Механизмы клеточно-опосредованной гиперчувствительности (IV типа)
- Виды аутоиммунных болезней
- Иммунологическая толерантность и ее механизмы
- Патогенез (механизм) аутоиммунитета
- Эпидемиология и критерии системной красной волчанки (СКВ)
- Причины и механизмы развития системной красной волчанки (СКВ)
- Морфология системной красной волчанки (СКВ)
- Клиника системной красной волчанки (СКВ)
- Причины и механизмы лекарственной красной волчанки
- Причины и механизмы развития синдрома Шегрена

