Схема нарушения нервно-мышечной передачи при миастении и синдроме Ламберта-Итона
Нервно-мышечная передача представляет собой последовательность событий, которые могут прерываться на различных уровнях. ПД распространяется посредством активации Na+-каналов до нервных окончаний, где он деполяризует клеточную мембрану, что приводит к открытию потенциалзависимых Са2+-каналов.
Ионы Са2+ входящие в нервные окончания, запускают выход из пресинаптической мембраны везикул, содержащих АХ, вследствие чего последний высвобождается в синаптическую щель. Затем АХ связывается с рецепторами на субсинаптической мембране и открывает неспецифические катионные каналы.
Деполяризация субсинаптической мембраны распространяется на постсинаптическую мембрану, где после открытия потенциалзависимых Na+-каналов возникает ПД, который быстро распространяется по всей мембране мышцы. АХ разрушается с помощью ацетилхолинэстеразы; образовавшийся холин вновь захватывается нервным окончанием и повторно используется для синтеза АХ.
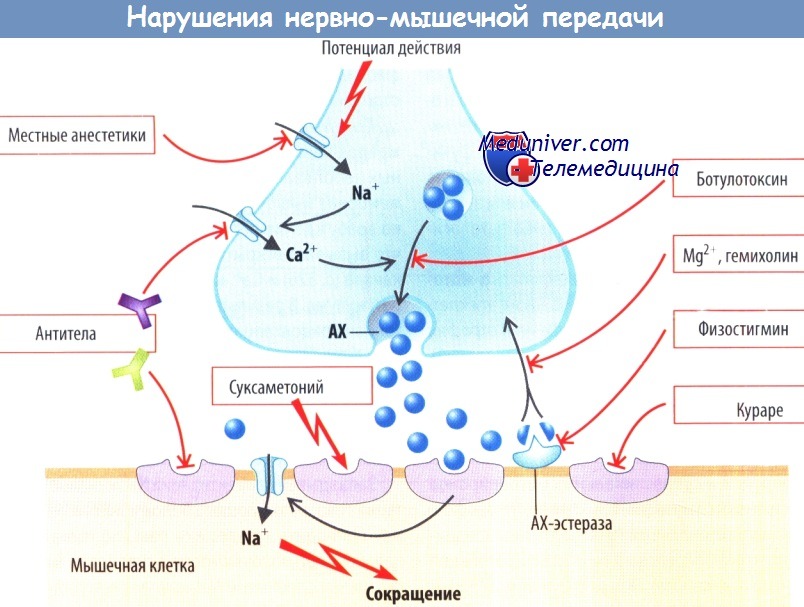
Патологические изменения могут затрагивать любой элемент этого процесса. Местные анестетики. например, ингибируют потенциалзависимые Na+-каналы нейронов, нарушая таким образом нервную передачу к концевой пластинке нервно-мышечного синапса. Са2+-каналы могут быть блокированы антителами. Ботулотоксин инактивирует белок синаптобревин, который отвечает за связывание везикул, содержащих АХ, с плазматической мембраной, т. е. за высвобождение АХ.
Ацетилхолиновые рецепторы, так же как и Са2+-каналы, могут блокироваться антителами, которые, кроме того, ускоряют интернализацию и разрушение этих рецепторов. Рецепторы могут быть блокированы и кураре, которое, не обладая своим собственным эффектом, конкурентно ингибирует связывание АХ с рецепторами.
Сукцинилхолин (суксаметония хлорид) приводит к продолжительной стимуляции рецепторов, длительной деполяризации постсинаптической мембраны, вызывая тем самым инактивацию постсинаптических Na+-каналов. Благодаря подобному действию он способен, как и кураре, блокировать нервно-мышечную передачу импульсов. В низких концентрациях вещества, ингибирующие ацетилхолинэстеразу (например, физостигмин), облегчают неровно-мышечную передачу путем увеличения доступности АХ в синаптической щели.
Однако в высоких дозах они замедляют нервно-мышечную передачу, т. к. высокие концентрации АХ и сукцинилхолина вызывают продолжительную деполяризацию субсинаптической мембраны, инактивируя тем самым постсинаптические Na+-каналы. Повторный захват холина нервными окончаниями может подавлять ионы Mg2+ и гемихолин.
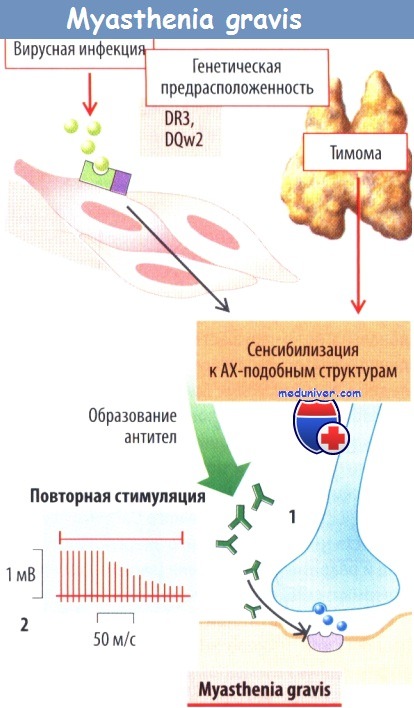
Важнейшим заболеванием, при котором поражаются концевые пластинки нервно-мышечных синапсов, является myasthenia gravis, характеризующаяся параличом мышц из-за блокады нервно-мышечной передачи импульсов. Это заболевание обусловлено образованием антител к рецепторам АХ на субсинаптической мембране, ускоряющих разрушение этих рецепторов. Это аутоиммунное заболевание могут провоцировать вирусные инфекции, при которых происходит стимуляция экспрессии молекул МНС, что облегчает распознавание антигена иммунной системой.
Миастения может встречаться также у пациентов с доброкачественной опухолью тимуса. Образование таких аутоантител чаще имеет место у лиц — носителей специфических подтипов (DR3 и DQw2) МНС класса II или HLA. В редких случаях миастения вызвана генетическими дефектами каналов, рецепторов АХ или ацетилхолинэстеразы. У пациентов, страдающих myasthenia gravis, повторная стимуляция двигательных нервов сначала будет вызывать образование в мышцах нормальных суммированных ПД, амплитуда которых, однако, будет уменьшаться вследствие прогрессирующего нарастания «усталости» нервно-мышечной передачи.
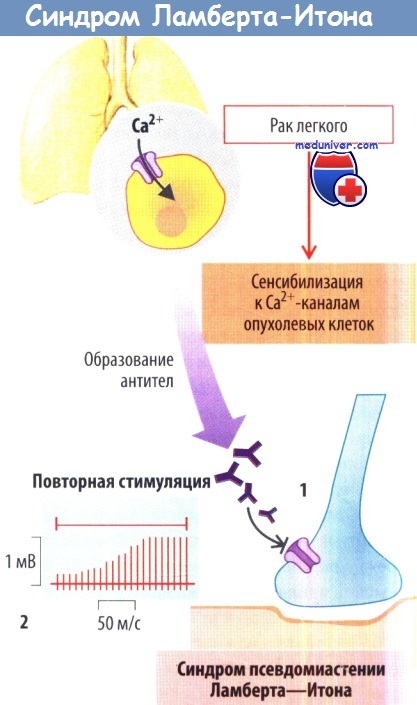
Другим иммунным аутоагрессивным заболеванием, при котором нарушается нервно-мышечная передача, является синдром псевдомиастении Ламберта—Итона. Это состояние часто развивается у больных мелкоклеточным раком легких. Са2+-каналы в плазматической мембране опухолевых клеток сенсибилизируют иммунную систему и стимулируют образование антител, которые взаимодействуют также с Са2+-каналами концевых пластинок нервно-мышечных синапсов.
Благодаря ингибированию Са2+-каналов суммированный ПД мышц сначала маленький, но затем он постепенно нормализуется, т. к. повторная стимуляция увеличивает количество Са2+, накапливающегося в нервных окончаниях.
Видео физиология синапса и нерва - профессор, д.м.н. П.Е. Умрюхин
Видео синдром Лаберта-Итона
- Рекомендуем ознакомиться со следующей статьей "Схема поражения двигательной единицы, миотонии и мышечной дистрофии"
Оглавление темы "Патофизиология в схемах":- Схема последствий избытка инсулина и развития гипогликемии
- Схема функций гистамина и брадикинина
- Схема функций серотонина
- Схема функций эйкозаноидов
- Схема вариантов повреждений нервной системы
- Схема болезней клеток нервной системы - нейронов
- Схема развития демиелинизации нервов при рассеянном склерозе
- Схема нарушения нервно-мышечной передачи при миастении и синдроме Ламберта-Итона
- Схема поражения двигательной единицы, миотонии и мышечной дистрофии
- Схема электромиографии и образования креатинина

