Механизм развития (патогенез) септического шока
Септический шок связан с тяжелыми гемодинамическими нарушениями, поэтому данный тип шока опишем более подробно. Уровень смертности от септического шока достигает 20%. Септический шок стоит первым в списке причин смерти в отделениях реанимации и ежегодно в США уносит жизни около 200 тыс. человек.
Кроме того, продолжающийся рост частоты септических синдромов объясняется улучшением жизнеобеспечения больных с высоким риском смерти, увеличением количества инвазивных процедур и растущим числом иммунонекомпетентных пациентов (из-за химиотерапии, иммуносупрессии или ВИЧ-инфекции).
Обычно септический шок наблюдается при грамотрицательных инфекциях (эндотоксический шок), но нередко развивается при заражении грамположительными микроорганизмами, а также при грибковой инфекции. Термин «эндотоксический шок» не отражает всю суть септического шока и не является правильным.
При септическом шоке системная вазодилатация и сброс крови приводят к развитию гипоперфузии периферических тканей даже при сохранном или увеличенном сердечном выбросе. Это сопровождается генерализованной активацией и повреждением эндотелия, что часто заканчивается развитием состояния гиперкоагуляции, которое манифестирует ДВС.
Кроме того, септическому шоку сопутствуют изменения метаболизма, которые напрямую подавляют клеточные функции. Конечный эффект этих изменений — гипоперфузия и мультиорганная дисфункция, приводящие к высокой смертности, связанной с развитием сепсиса.
Способность различных микроорганизмов вызывать септический шок (иногда при наличии инфекции только в одном участке тела) согласуется с фактом инициации процесса несколькими микробными компонентами. Макрофаги, нейтрофилы и другие клетки системы врожденного иммунитета экспрессируют множество рецепторов, которые отвечают на разные продукты микроорганизмов.
После активации эти клетки высвобождают медиаторы воспаления и различные факторы иммуносупрессии, которые изменяют ответ организма-хозяина. Кроме того, продукты микроорганизмов активируют гуморальные элементы врожденного иммунитета, особенно системы комплемента и коагуляции. Эти медиаторы и комплексное прямое воздействие на эндотелиальные клетки, оказываемое продуктами микроорганизмов, вызывают септический шок.

Основные факторы патофизиологических механизмов септического шока:
- медиаторы воспаления. Различные компоненты стенки клетки микроорганизма связываются с поверхностными рецепторами нейтрофилов, мононуклеарных клеток воспаления и эндотелиоцитов, вызывая их активацию. TLR распознают элементы микроорганизмов и запускают ответ, который инициирует сепсис. Тем не менее мыши с генетической недостаточностью TLR все еще умирают от сепсиса, поэтому считается, что есть и другие пути инициации септической реакции у человека (например, через G-белок-связанные рецепторы, которые распознают бактериальные пептиды и нуклеотиды олигомеризационного домена белков 1 и 2 [NOD1, NOD2]).
Во время активации клетки воспаления продуцируют TNF, IFN-y, IL-1, IL-12 и IL-18, а также другие медиаторы воспаления, например белок HMGB1. В этом процессе принимают участие и АФК, и липидные медиаторы, такие как простагландины и PAF. Эти эффекторные молекулы активируют эндотелиальные клетки (и другие типы клеток), приводя к экспрессии молекул адгезии, прокоагулянтному фенотипу и продукции цитокинов второй волны. Продукты микроорганизмов активируют каскад системы комплемента напрямую и через протеолитическую активность плазмина, приводя к продукции анафилотоксина (С3а, С5а), хемотаксических фрагментов (С5а) и опсонинов (С3b), которые запускают провоспалительную реакцию.
Кроме того, такие продукты микроорганизмов, как эндотоксин, могут активировать коагуляцию прямым воздействием на фактор XII и опосредованно через измененную функцию эндотелия. Системное прокоагулянтное состояние, вызванное сепсисом, не только приводит к тромбозу, но и усиливает воспаление через расположенные на клетках воспаления рецепторы, активируемые протеазами;
- активация и повреждение эндотелиоцитов. Активация эндотелиоцитов и выброс лейкоцитарных медиаторов воспаления могут привести к тромбозу, повышению сосудистой проницаемости и вазодилатации. У 50% септических пациентов нарушение коагуляции грозит развитием опасного осложнения — ДВС-синдрома. Сепсис меняет экспрессию многих факторов для усиления коагуляции.
Провоспалительные цитокины вызывают повышение продукции тканевого фактора эндотелиальными клетками (а также моноцитами), в то же время сдерживая фибринолиз, повышая экспрессию ингибитора-1 активатора плазминогена. Продукция других эндотелиальных факторов коагуляции, например ингибитора пути тканевого фактора, тромбомодулина и С-белка, падает.
Прокоагулянтная тенденция усугубляется уменьшением периферического кровотока, стазом и снижением вымывания активированных факторов коагуляции. Совместное действие этих факторов приводит к накоплению тромбов, богатых фибрином, что также способствует гипоперфузии тканей. При развившемся ДВС-синдроме наблюдается значительный расход факторов коагуляции и тромбоцитов, вследствие чего возникает их дефицит, ведущий к кровотечениям и кровоизлияниям.
Повышение сосудистой проницаемости ведет к экссудации жидкости в интерстиций с отеком и повышением давления интерстициальной жидкости, что в дальнейшем препятствует кровотоку в тканях, особенно у пациентов на искусственной вентиляции легких.
Эндотелий тоже повышает экспрессию iNOS и продукцию NO. Эти изменения вместе с повышением концентрации вазоактивных медиаторов воспаления (например, С3а, С5а и PAF) вызывают системную релаксацию гладких мышц сосудов, ведущую к гипотензии и снижению перфузии тканей;
- метаболические изменения. Септическое состояние сопровождается инсулиновой резистентностью и гипергликемией. Цитокины (например, TNF и IL-1), стресс-индуцированные гормоны (например, глюкагон, гормон роста и глюкокортикостероиды), а также катехоламины усиливают глюкогенез. В то же время провоспалительные цитокины подавляют высвобождение инсулина, одновременно усиливая инсулиновую резистентность в печени и других тканях, в большей степени снижая экспрессию GLUT-4, являющегося транспортером глюкозы.
Гипергликемия ведет к снижению функции нейтрофилов (тем самым ослабляя их бактерицидную активность) и вызывает повышенную экспрессию молекул эндотелиальной адгезии. Тем не менее сепсису сначала сопутствует резкий подъем продукции глюкокортикостероидов. Данная фаза часто сопровождается недостаточностью надпочечников и функциональным дефицитом глюкокортикостероидов. Эта фаза может начаться с депрессии способности к синтезу интактных надпочечников или выраженного некроза надпочечников вследствие ДВС-синдрома (синдром Уотерхауса-Фридериксена);
- иммуносупрессия. Гипервоспалительная реакция, вызванная сепсисом, может активировать иммуносупрессивные механизмы обратной связи, которые могут вовлекать адаптационные механизмы и врожденного, и приобретенного иммунитета. Предположительными механизмами иммунной супрессии могут быть смена провоспалительных цитокинов (Тh1-клеток) на противовоспалительные (Тh2-клетки), продукция противовоспалительных медиаторов (например, растворимого рецептора TNF, антагониста рецептора IL-1 и IL-10), лимфоцитарный апоптоз, иммуносупрессивные действия апоптозных клеток и индукция клеточной анергии. До сих пор непонятно, каким свойством обладают иммуносупрессивные медиаторы при сепсисе: разрушающим или протективным;
- органная дисфункция. Системная гипотензия, интерстициальный отек и тромбоз мелких сосудов снижают доставку кислорода и питательных веществ к тканям, которые не могут нужным образом использовать питательные вещества вследствие изменения клеточного метаболизма. Высокие уровни цитокинов и вторичных медиаторов могут снизить сократимость миокарда и сердечный выброс и повысить сосудистую проницаемость, а повреждение эндотелия — привести к развитию респираторного дистресс-синдрома взрослых. В итоге эти факторы могут вызвать полиорганную недостаточность, включая почки, печень, легкие и сердце, что может стать причиной смерти.
Тяжесть и исходы септического шока в большей степени зависят от тяжести и вирулентности инфекции, иммунного статуса организма-хозяина и качества и количества медиаторов. Многочисленность факторов и комплексность взаимодействия, лежащие в основе сепсиса, объясняют, почему внутривенное применение антагонистов специфических медиаторов может быть не только неэффективно, но и в некоторых ситуациях оказывать повреждающее воздействие. Стандарты лечения включают терапию антибиотиками, инсулинотерапию при гипергликемии, восстановление жидкостного баланса для нормализации системного давления и назначение «физиологических доз» кортикостероидов для коррекции относительной адреналовой недостаточности.
Назначение активированного С-белка в целях профилактики образования тромбина и снижения коагуляции и воспаления в некоторых случаях при тяжелом сепсисе может быть полезным, но это спорно. Даже в лучших клиниках септический шок остается сложной клинической ситуацией.
Дополнительная группа бактериальных белков-суперантигенов тоже вызывает синдром, близкий к септическому шоку (например, синдром токсического шока). Суперантигены — это поликлональные активаторы Т-лимфоцитов, которые вызывают высвобождение большого количества цитокинов, что приводит к развитию разных клинических симптомов, начиная от диффузной крапивницы до вазодилатации, а также к гипотензии и в конечном итоге к летальному исходу.
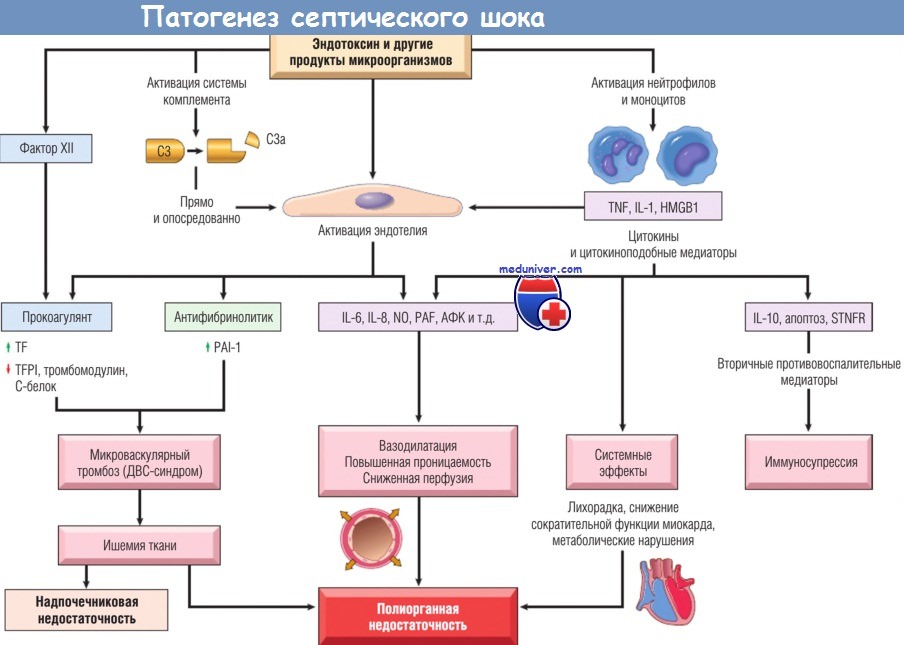
Продукты микроорганизмов активируют эндотелиальные клетки, а также клеточные и гуморальные элементы врожденного иммунитета,
инициируя цепь событий, приводящих к последней стадии — полиорганной недостаточности.
HMGB1 — белок из высокомобильной группы 1; IL — интерлейкин; NО — оксид азота;
PAF — фактор активации тромбоцитов; PAI — ингибитор активатора плазминогена; STNFR — растворимый рецептор фактора некроза опухоли;
TF — тканевый фактор; TFPI — ингибитор пути тканевого фактора; TNF — фактор некроза опухоли;
АФК — активные формы кислорода; ДВС — диссеминированное внутрисосудистое свертывание.
- Рекомендуем ознакомиться со следующей статьей "Стадии шока, их морфология и клиника"
Оглавление темы "Патофизиология":- Типы шока и их характеристика
- Механизм развития (патогенез) септического шока
- Стадии шока, их морфология и клиника
- Структура генома человека и значение микроРНК
- Причины генетических болезней человека и их патогенез
- Типы мутаций и их характеристика
- Менделевские заболевания и их характеристика
- Аутосомно-доминантные заболевания и их характеристика
- Аутосомно-рецессивные заболевания и их характеристика
- Заболевания, сцепленные с Х-хромосомой и их характеристика

