Механизмы развития (патогенез) ожирения
Ожирение и избыточная масса тела ассоциируются с увеличением числа некоторых наиболее значимых заболеваний человека, в т.ч. сахарного диабета типа II, дислипидемий, сердечно-сосудистых заболеваний, гипертонии и злокачественных опухолей. Ожирение — это увеличение массы тела в результате накопления жировой ткани в количестве, достаточном для оказания неблагоприятного влияния на здоровье.
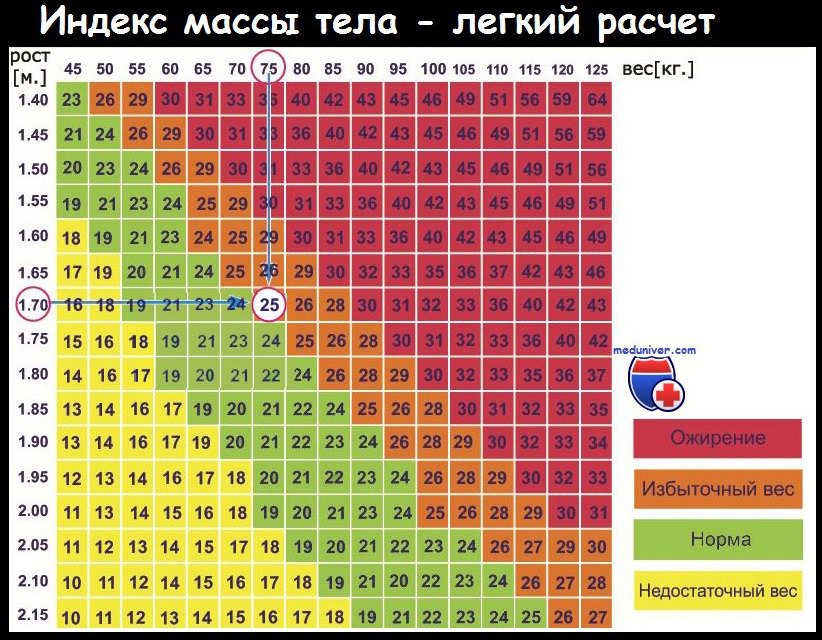
Как и потерю массы тела, избыточную массу оценивают по ИМТ. Нормальный ИМТ составляет 18,5-25 кг/м2, но может различаться в разных странах. ИМТ выше 30 кг/м2 классифицируют как ожирение, а ИМТ между 25 и 30 кг/м2 считают избыточной массой тела. Далее для простоты термином «ожирение» мы будем обозначать и настоящее ожирение, и избыточную массу тела.
Количество жира в организме можно оценить по толщине кожной складки над трехглавой мышцей плеча, предплечья и по отношению окружности талии к окружности бедер. При ожирении значение имеет не только общая масса тела, но и распределение жира.
Центральное (или висцеральное) ожирение, при котором жир накапливается в туловище и брюшной полости (в сальнике и вокруг внутренних органов), связано с существенно более высоким риском развития некоторых болезней, чем избыточное накопление жира в подкожной ткани.
Ожирение — одна из главных проблем здравоохранения, которая до недавнего времени ограничивалась только развитыми странами. Однако в настоящее время эта проблема стала актуальной и для развивающихся стран, причем в некоторых из них ожирение сосуществует с недоеданием.
В США ожирение достигло масштабов эпидемии. Его распространенность возросла с 13 до 32% в период между 1960 и 2004 гг., а в настоящее время 66% взрослого населения США имеют избыточную массу тела и страдают ожирением. Рост ожирения в США связывают с повышенной калорийностью пищи, в основном в связи с потреблением рафинированных сахаров, сладких напитков и растительных масел. Если такая тенденция сохранится, то к 2015 г. ожирением будет страдать 41% взрослого населения.
Иными словами, ожирение — это болезнь, обусловленная повышенным потреблением калорий по сравнению с потребностью организма. Однако патогенез ожирения чрезвычайно сложен и пока не до конца понятен. Текущие исследования выявили сложные нейрогуморальные механизмы, контролирующие аппетит и чувство сытости. Эти механизмы отвечают на генетические, пищевые, экологические и психологические сигналы, вызывая метаболический ответ путем стимуляции центров гипоталамуса.
Несомненно, что генетические факторы играют важную роль в контроле массы тела, но ожирение — это болезнь, которая зависит от взаимодействия нескольких факторов. В конце концов, ожирение не может развиться без приема пищи!
Упрощенно нейрогуморальные механизмы, регулирующие энергетический баланс, можно разделить на три группы:
- афферентная (периферическая) система генерирует сигналы от различных участков. Ее основные компоненты — лептин и адипонектин, синтезируемые жировыми клетками, грелин (желудок) и пептид YY (PYY) (подвздошная и ободочная кишки), а также инсулин (поджелудочная железа);
- дугообразное ядро гипоталамуса обрабатывает и интегрирует периферические нейрогуморальные сигналы и генерирует эфферентные сигналы. Оно содержит две подгруппы нейронов первого порядка: (1) нейроны РОМС (проопиомеланокортин) и CART (кокаин- и амфетамин-регулируемый транскрипт); (2) нейроны, содержащие нейропептид Y (NPY) и агути-связанный пептид (AgRP). Нейроны первого порядка взаимодействуют с нейронами второго порядка;
- эфферентная система переносит сигналы нейронов второго порядка гипоталамуса, контролирующие поступление пищи и расход энергии. Гипоталамическая система также взаимодействует с центрами переднего и среднего мозга, управляющими вегетативной нервной системой.
Нейроны POMC/CART увеличивают расход энергии и потерю массы тела за счет образования подавляющего аппетит (анорексигенного) а-меланоцитостимулирующего гормона (MSH) и активации рецепторов меланокортина 3 (MC3R) и 4 (MC4R) в нейронах второго порядка. Нейроны NPY/AgRP вырабатывают нейропептид Y, повышающий аппетит (орексигенный), и активируют рецепторы Y15 в нейронах второго порядка.
Теперь обсудим три важных компонента афферентной системы, регулирующей аппетит и чувство сытости: лептин, адипонектин и гормоны кишечника.
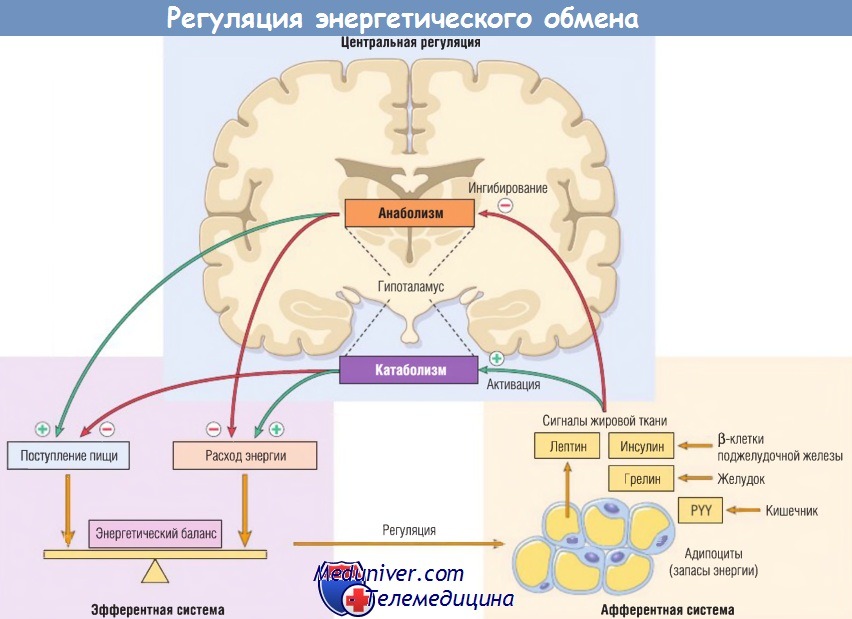
Жировая ткань генерирует афферентные сигналы, влияющие на деятельность гипоталамуса, который является центральным регулятором аппетита и сытости.
Эти сигналы снижают потребление пищи, ингибируя анаболизм, и повышают расход энергии путем активации катаболизма.
PYY — пептид YY.
а) Лептин. Термин «лептин» происходит от греческого слова «лептос», что означает «тонкий». Лептин — гормон массой 16 кДа, синтезируемый жировыми клетками, является продуктом гена оЪ. Лептиновый рецептор (OBR) — продукт гена db (diabetes) и относится к суперсемейству цитокиновых рецепторов типа I, включающему gpl30, рецепторы гранулоцитарного колониестимулирующего фактора, IL-2 и IL-6.
Мыши с генетически обусловленным дефицитом лептина (ob/ob мыши) или его рецепторов (db/db мыши) переедают и набирают избыточную массу тела, причем их поведение, аналогично поведению при недостаточном питании. Таким образом, ожирение у этих животных является следствием отсутствия сигнала о достаточном количестве энергии, который обычно обеспечивает лептин.
Хотя уровень лептина обусловлен адекватными запасами жира, точные механизмы его выхода из жировой ткани до конца не определены. Но было установлено, что секреция лептина стимулируется наличием больших запасов жира. Важным фактором регуляции уровня лептина считают инсулин-стимулированный метаболизм глюкозы. В гипоталамусе лептин стимулирует нейроны POMC/CART, синтезирующие анорексигенные нейропептиды (прежде всего MSH), и тормозит нейроны NPY/AgRP, синтезирующие орексигенные нейропептиды.
У лиц со стабильной массой тела активность противоположных путей POMC/CART и NPY/AgRP сбалансирована. При недостатке жировой ткани в организме секреция лептина снижается и чувство голода усиливается.
У лиц с мутациями, приводящими к утрате функции лептиновой системы, наблюдается тяжелое раннее ожирение, но это редкое состояние. Мутации MC4R и дальнейших сигнальных путей встречаются чаще, являясь причиной 5% случаев тяжелого ожирения. У таких людей чувство насыщения (анорексигенные сигналы) отсутствует, и они ведут себя, как будто не получают достаточного питания.
Недавно стало известно, что гаплоидная недостаточность нейротрофического фактора мозга (BDNF), важного компонента сигнального пути MC4R в гипоталамусе, связана с ожирением у лиц с синдромом WAGR — очень редким заболеванием, включающим помимо ожирения опухоль Вильмса (Wilms tumor), аниридию (aniria), нарушения мочеполовой системы (genitourinary defects) и умственную отсталость (mental retardation).
Хотя дефекты лептина и MC4R обнаруживаются редко, они подчеркивают важность этих систем в регуляции энергетического баланса и массы тела. Возможно, в патогенез ожирения вовлечены и другие нарушения. Например, было высказано предположение, что у людей чаще встречается резистентность к лептину, чем его дефицит.
Лептин регулирует не только потребление пищи, но и расход энергии. При избытке лептина увеличиваются физическая активность и теплоотдача. Нейрогуморальные пути влияния лептина на расход энергии менее изучены. Термогенез, наиболее важный эффект катаболизма, связанный с лептином, частично регулируется гипоталамическими сигналами, увеличивающими высвобождение норадреналина в симпатических нервных окончаниях в жировой ткани.
Помимо этого, лептин может функционировать в качестве провоспалительного цитокина и участвовать в регуляции гемопоэза и лимфопоэза. Рецептор OBR структурно очень похож на рецептор IL-6 и активирует путь JAK/STAT.
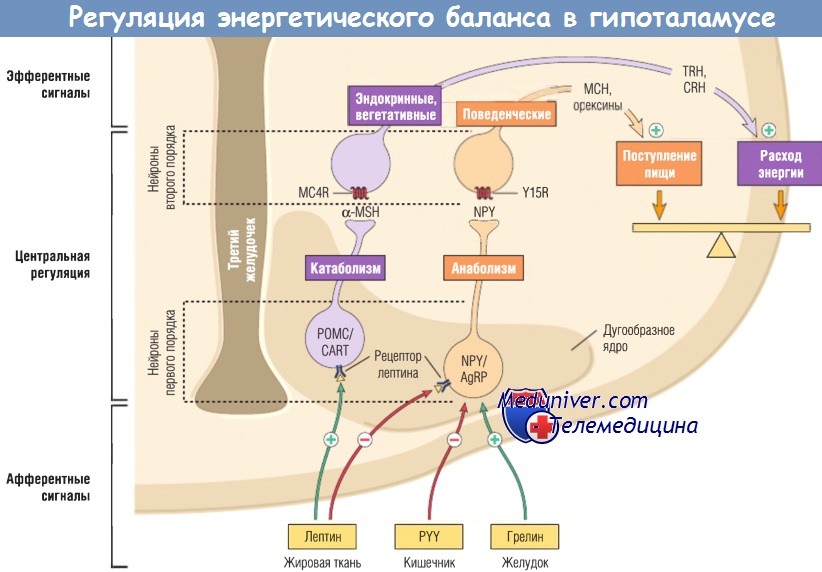
Показаны анорексигенные нейроны POMC/CART и орексигенные нейроны NPY/AgRP дугообразного ядра гипоталамуса и их пути.
AgRP — агути-связанный пептид; CART — кокаин- и амфетамин-регулируемый транскрипт;
CRH — кортикотропин-рилизинг-гормон; MC4R — рецептор меланкортина 4;
МСН — меланинконцентрирующий гормон; MSH — меланоцитостимулирующий гормон;
NPY — нейропептид Y; РОМС — проопиомеланокортин; PYY — пептид YY;
TRH — тиротропин-рилизинг-гормон; Y15R — рецептор Y15.
б) Адипонектин. Инъекции адипонектина стимулируют у мышей окисление жирных кислот в мышечной ткани, что приводит к уменьшению жировой массы. Этот гормон производится главным образом адипоцитами. Его уровень в крови очень высок, примерно в 1000 раз выше, чем других полипептидных гормонов, но ниже у лиц с ожирением, чем у худых.
Адипонектин, названный сжигателем жира и ангеломхранителем от ожирения, направляет жирные кислоты в мышцы для окисления. Это снижает поступление жирных кислот и общее содержание триглицеридов в печени, а также производство ею глюкозы, повышая чувствительность к инсулину и предотвращая метаболический синдром. Адипонектин циркулирует как комплекс из трех, шести и более агрегатов мономеров и связывается с двумя рецепторами — AdipoR1 и AdipoR2. Эти рецепторы находятся во многих тканях, включая мозг, но AdipoR1 больше в скелетных мышцах, a AdipoR2 — в печени.
Связывание адипонектина с рецептором запускает сигналы, активирующие цАМФ-активируемую протеинкиназу, которая, в свою очередь, фосфорилирует и инактивирует ацетил-коэнзим А-карбоксилазу — ключевой фермент, необходимый для синтеза жирных кислот.
в) Жировая ткань. Кроме лептина и адипонектина жировая ткань продуцирует такие цитокины, как TNF, IL-6, IL-1 и IL-18, хемокины и стероидные гормоны. Повышенное образование цитокинов и хемокинов жировой тканью у тучных пациентов приводит к хроническому субклиническому (бессимптомному) воспалительному состоянию с высоким уровнем циркулирующего С-реактивного белка. Таким образом, жировая ткань участвует в контроле баланса энергии и обмена веществ, являясь связующим звеном между липидным обменом, питанием и воспалительным ответом, а адипоцит теперь занимает важнейшее место в исследованиях обмена веществ.
Общее число адипоцитов предопределено в детстве и юности, и оно выше у лиц с ожирением, чем у худых. У взрослых число адипоцитов остается неизменным даже после потери или увеличения массы тела, но существует непрерывная смена клеточной популяции. Подсчитано, что у человека ежегодно обновляются 10% адипоцитов независимо от массы тела. У лиц, снизивших массу тела, основные трудности в ее поддержании связаны, в частности, с отсутствием уменьшения количества адипоцитов, а также повышением аппетита, вызванным недостатком лептина.
г) Гормоны кишечника. Кишечные пептиды — это группа короткодействующих инициаторов и терминаторов пищеварения. Она включает грелин, PYY, панкреатический полипептид, инсулин, амилин и другие. Грелин вырабатывается в желудке и дугообразном ядре гипоталамуса. Это единственный известный кишечный гормон, который имеет орексигенный эффект (увеличивает потребление пищи). Его инъекция вызывает у грызунов ненасытный голод даже после многократного кормления. Длительные инъекции приводят к увеличению массы тела за счет повышения потребления калорий и снижения расхода энергии.
Грелин действует путем связывания рецепторов стимулирующего секрецию гормона роста, который в большом количестве присутствует в гипоталамусе и гипофизе. Точные механизмы действия грелина не идентифицированы, скорее всего, он стимулирует нейроны NPY/AgRP, что приводит к увеличению потребления пищи. Уровень грелина повышается перед едой и снижается через 1-2 час после еды, однако у тучных лиц уровень грелина после еды снижается меньше, что приводит к сохранению ожирения.
Пептид YY выделяется эндокринными клетками подвздошной кишки и толстой кишки. В плазме крови уровень PYY низок натощак и увеличивается вскоре после приема пищи. Внутривенное введение PYY снижает потребление пищи, и после операции желудочного шунтирования его уровень, как правило, увеличивается.
У лиц с синдромом Прадера-Вилли уровень PYY в целом снижен (вызван утратой импринтинговых генов на хромосоме 15q11-q13) и может способствовать развитию у этих лиц гиперфагии и ожирения. Эти наблюдения заложили основу для исследований применения PYY для лечения ожирения.
Для лечения ожирения и диабета также изучают амилин — пептид, выделяемый наряду с инсулином b-клетками поджелудочной железы и снижающий потребление пищи и массу тела. Как PYY, так и амилин обладают центральным действием и стимулируют нейроны POMC/CART в гипоталамусе, что приводит к уменьшению потребления пищи.
- Рекомендуем ознакомиться со следующей статьей "Последствия ожирения и почему надо худеть?"
Оглавление темы "Патофизиология питания":- Обмен витамина А и его функции
- Признаки дефицита витамина А и отравления им
- Обмен витамина D и его функции
- Признаки дефицита витамина D и отравления им
- Обмен витамина С и его функции
- Признаки дефицита витамина С и отравления им
- Механизмы развития (патогенез) ожирения
- Последствия ожирения и почему надо худеть?
- Механизмы влияния питания на развитие опухоли
- Механизмы влияния питания на развитие атеросклероза

