Схема механизмов развития иммунодефицита
Иммунодефициты характеризуются частым развитием продолжительных, иногда опасных для жизни инфекционных заболеваний (в т. ч. обусловленных и непатогенными инфекционными агентами), а также различных опухолей.
а) Среди расстройств неспецифической защиты выделяют дефекты системы комплемента, проявлениями которых служат инфекции, вызванные внеклеточными патогенами, в частности нейссериями; дефекты NK-клеток, проявляющиеся инфекциями, возбудителями которых являются внутриклеточные патогены (листерии, вирус герпеса); дефекты, развившиеся в результате нарушения белков, связывающих маннозу.
Нарушения фагоцитоза могут быть обусловлены уменьшением количества фагоцитов (при лейкопении, развившейся из-за дефицита Г-КСФ; при агранулоцитозе вследствие лучевой или химиотерапии) либо угнетением их функции. При аномалии адгезии лейкоцитов в результате дефекта строения субъединицы интегринов (CD18) нарушена маргинация лейкоцитов; при синдроме «ленивых» лейкоцитов замедлена их миграция в очаг воспаления; при хронической гранулематозной болезни лейкоциты не образуют достаточного количества оксидантов, а при синдроме Чедиака—Хигаси нарушен процесс слияния фагосомы и лизосомы.
б) Дефекты гуморального иммунитета могут быть вызваны нарушениями созревания, функционирования или активации В-лимфоцитов. При отсутствии антител организм становится уязвимым, особенно для гноеродных микроорганизмов, т. к. они подвергаются фагоцитозу без предварительной опсонизации полисахаридов, входящих в состав их мембран. Ктаким иммунодефицитам относятся:
1) селективный дефицит IgA (распространен очень широко, частота в общей популяции 1:700). Характеризуется снижением защитных свойств слизистых оболочек, что проявляется частыми инфекциями дыхательных путей и ЖКТ, а также повышенной склонностью к развитию аллергических реакций;
2) наследственная агаммаглобулинемия, обусловленная дефектом тирозиновой киназы Брутона, в результате чего нарушается созревание В-лимфоцитов. Тип наследования этой формы патологии — сцепленный с Х-хромосомой;
3) синдром гипериммуноглобулинемии М, характеризующийся значительным повышением концентрации IgM при снижении концентрации IgG и IgA. Это обусловлено нарушением «переключения» синтеза разных классов иммуноглобулинов вследствие дефекта лигандов CD40;
4) так называемый вариабельный иммунодефицит, характеризующийся нарушением стимуляции В-лимфоцитов CD4 Т-лимфоцитами.
в) Нарушения клеточного иммунитета развиваются при аплазии тимуса (синдром Ди Джорджи), а также в сочетании с расстройствами гуморального иммунитета. Их проявления варьируют от неправильной дифференцировки стволовых клеток (ретикулярная дисгенезия) вследствие нарушения образования HLA (синдром «голых» лейкоцитов) до тяжелых синдромов, при которых уменьшается продолжительность жизни в результате расстройств В- и Т-клеточного иммунитета (тяжелый комбинированный иммунодефицит, обусловленный дефицитом аденозиндезаминазы или фосфорилазы пуриновых нуклеотидов).
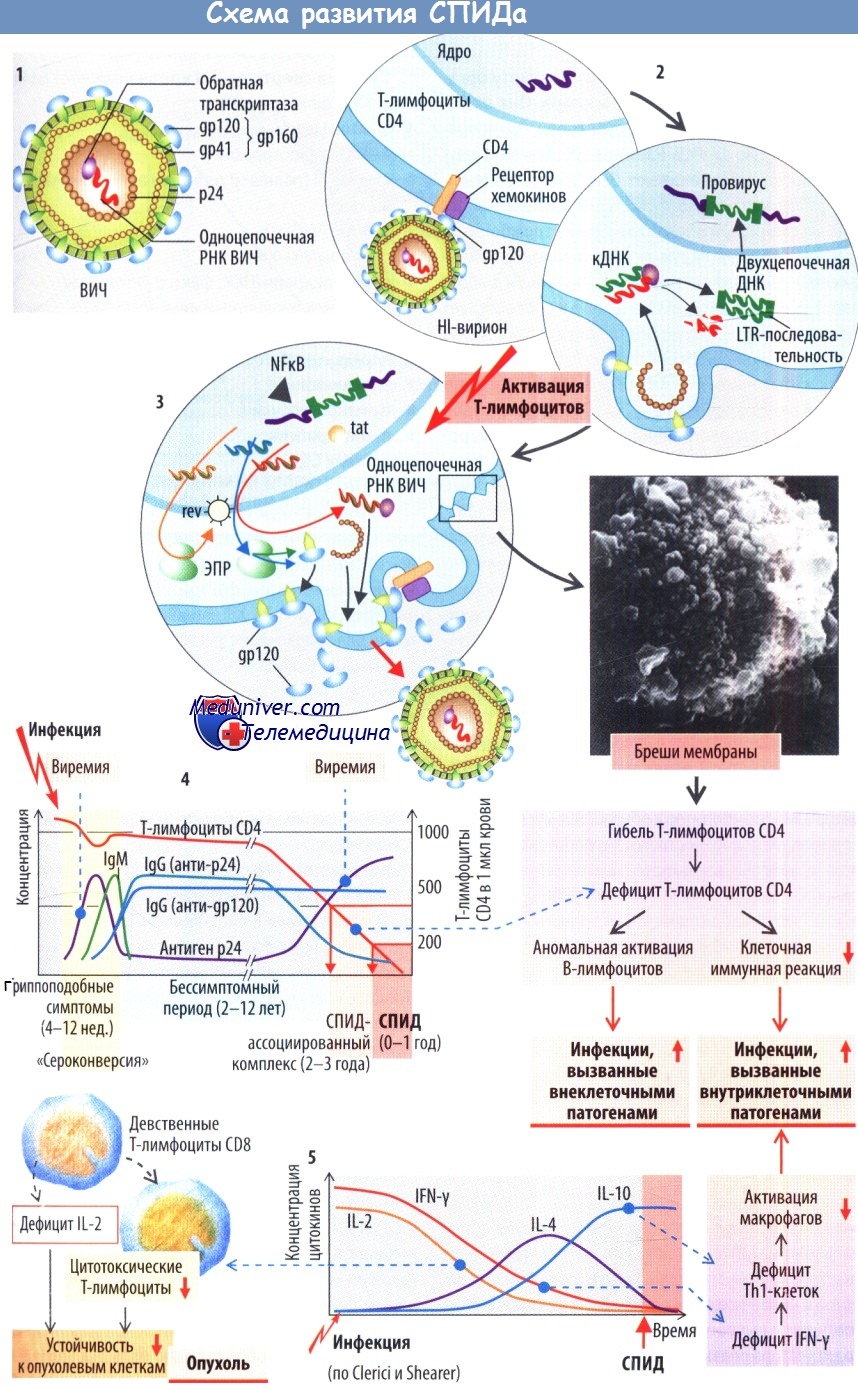
г) СПИД (синдром приобретенного иммунодефицита) вызывают вирусы иммунодефицита человека ВИЧ-1 или ВИЧ-2. Геном этого ретровируса состоит из двух практически идентичных молекул одноцепочечной скрученной РНК. В состав вириона (полной вирусной частицы) входит белок gp120, который связывается с CD4 и рецептором хемокинов (в начале инфекции — с CCR5, в конечной стадии — с CXCR4) на поверхности мембран клеток организма, что обеспечивает слияние мембраны клетки с вирусом и эндоцитоз вириона. Кстати, лица с дефектами CCR5 в значительной степени защищены от ВИЧ-инфекции.
Помимо клеток CD8 важнейшей мишенью в этих условиях являются и Th-клетки CD4. В последних вирусная РНК с помощью обратной транскриптазы транскрибируется в кДНК. В итоге двойная спираль провирусной ДНК внедряется в геном иммунных клеток человека (латентная стадия вирусной инфекции). Активация клеток CD4 (в начале инфекции и на ее поздних стадиях) запускает экспрессию провируса. Белки tat и rev, образующиеся при этом, а также NFkB в клетках организма участвуют в формировании новых вирионов, которые затем выводятся из клеток путем экзоцитоза, т. е. развивается виремия.
Во время этой стадии клетки CD4 могут разрушаться, особенно из-за действия системы собственной иммунной защиты (анти-gp120—IgG + комплемент; распознавание вирусных пептидов цитотоксическими Т-лимфоцитами). Также погибают и неинфицированные CD4-лимфоциты (вследствие апоптоза, не зависящего от HLA). В результате на поздних стадиях инфекции развивается выраженный дефицит CD4-лимфоцитов. Изменения концентрации цитокинов способствуют гибели примерно 1/10 Th1-клеток и цитотоксических Т-лимфоцитов.
В этих условиях организм становится более уязвимым по отношению к патогенам, обычно не причиняющим особого вреда. Это проявляется грибковыми инфекциями и развитием определенных видов новообразований (саркома Капоши, лимфома).
При снижении числа лимфоцитов CD4 < 500/мкл развивается СПИД-ассоциированный комплекс; уменьшение количества лимфоцитов CD4 < 200/мкл соответствует СПИДу. От стадии начальной виремии, характеризующейся высоким уровнем антигена р24 с образованием IgM, до развития СПИД-ассоциированного комплекса с возобновлением виремии (без дополнительного образования IgM) могут пройти многие годы, в течение которых провирусы сохраняются в относительно небольших количествах в неактивных клетках CD4 (главным образом, в лимфатических узлах).
- Рекомендуем ознакомиться со следующей статьей "Схема свертывания крови - гемостаза"
Оглавление темы "Патофизиология болезней в схемах":- Схема причин развития аутоиммунных болезней
- Схема механизмов развития иммунодефицита
- Схема свертывания крови - гемостаза
- Схема механизмов нарушения развития свертывания крови - гемостаза
- Схема патофизиологии дыхания и его терминов
- Физиология вентиляции и перфузии легких
- Схема нарушения диффузии кислорода и углекислого газа
- Схема нарушения распределения газов в легких
- Схема причин и механизма рестриктивных нарушений дыхания
- Схема причин и механизма обструктивных нарушений дыхания

