Механизмы развития (патогенез) неоплазий лейкоцитов
Самой клинически значимой патологией системы лейкоцитов является их малигнизация. Злокачественные болезни лейкоцитов подразделяют на несколько категорий:
- лимфоидные неоплазии. Включают гетерогенную группу опухолей В-, Т- и NK-клеточного происхождения. Во многих случаях фенотип неопластических клеток напоминает фенотип определенных стадий дифференцировки нормальных лимфоцитов — признак, используемый для диагностики и классификации этих патологий;
- миелоидные неоплазии. Возникают из ранних гемопоэтических клеток-предшественников. Выделяют 3 группы миелоидных неоплазий: острые миелоидные лейкемии (накопление в костном мозге незрелых клеток-предшественников); миелодиспластические синдромы (ассоциируются с неэффективным гемопоэзом и возникающей в результате этого цитопенией в периферической крови); миелопролиферативные заболевания (повышенная продукция одного или нескольких терминально дифференцированных миелоидных элементов, например гранулоцитов, обычно приводит к увеличению количества клеток в периферической крови);
- гистиоцитозы. Относят к редким пролиферативным нарушениям системы макрофагов и дендритных клеток. Морфологический термин «гистиоциты» (буквально: тканевые клетки) уже стал архаичным, однако его по-прежнему используют. Клетки Лангерганса, особый тип незрелых дендритных клеток, подвержены целому спектру неопластических расстройств — гистиоцитозам клеток Лангерганса.
Этиология и патогенез неоплазий лейкоцитов. Неопластические изменения лейкоцитов крайне вариабельны. Рассмотрим несколько общих вопросов этиологии и патогенеза данных расстройств.
а) Хромосомные транслокации и другие приобретенные мутации. В большинстве случаев лейкоцитарных неоплазий выявляют хромосомные аномалии, чаще всего транслокации. Многие специфические перестройки хромосомассоциируются с определенными неоплазиями, что свидетельствует о существенной роли хромосомных аномалий в генезе этих неоплазий.
Гены играют решающую роль в развитии, росте и выживании нормальных клеток-предшественников, и результатом мутаций генов может быть образование доминантно-негативного белка, нарушающего функцию клетки (утрата функции), или аномального усиления какого-то вида активности (приобретение функции).
В некоторых опухолях различные аберрации имеют одинаковые функциональные последствия в результате конвергенции аберраций на общем важном сигнальном пути или на факторе транскрипции. Примером могут служить MALT-лимфомы (опухоли из лимфоидной ткани, ассоциированной со слизистыми оболочками, или мальтомы) и В-клеточные лимфомы, развивающиеся в слизистой оболочке вне лимфатических узлов. Эти лимфомы часто ассоциируются с транслокациями гена MALT1 или BCL10.
Белки MALT1 и BCL10 связываются с другим белковым комплексом, регулирующим активность ядерного фактора каппа В (NF-kB) — фактора транскрипции, играющего жизненно важную роль в функционировании нормальных лимфоцитов. Конечный эффект транслокации гена MALT1 и гена BCL10 одинаков — нарушение регуляции комплекса MALT1-BCL10, которое вызывает конститутивную активацию NF-kB и, как будет показано далее, играет определенную роль в патогенезе многих злокачественных лимфоидных опухолей.
Онкобелки, образующиеся в результате геномных аберраций, нередко блокируют созревание клеток. Многие из онкобелков останавливают дифференцировку клетки, часто на стадии быстрого деления. Значение созревания наиболее очевидно при острых лейкемиях, когда доминантно-негативные мутации факторов транскрипции, интерферирующих с ранними стадиями дифференцировки лимфоидных или миелоидных клеток, сочетаются с мутациями, активирующими тирозинкиназы, которые повышают выживаемость и пролиферацию клеток. Это относится также к более зрелым лимфоидным опухолям.
Например, BCL6 кодирует фактор транскрипции, экспрессированный в В-клетках герминативного центра. В отсутствие BCL6 герминативный центр не образуется. Однако функция BCL6 в герминативном центре должна быть выключена, чтобы В-клетки могли созревать до В-клеток памяти и плазматических клеток. Как будет показано далее, аберрации, повышающие экспрессию BCL6 и предотвращающие снижение его экспрессии, — весьма частое явление в некоторых лимфомах, развивающихся из В-клеток герминативного центра.
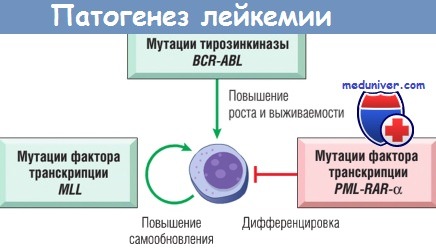
Острые лейкемии возникают в результате комплементарных мутаций,
которые останавливают дифференцировку лейкоцитов на ранних стадиях их развития,
усиливают их регенерацию, пролиферацию и выживаемость. Показаны примеры значимых мутаций.
BCR-ABL — гибридный ген, кодирующий киназу Абельсона;
MLL — ген миелоидной и лимфоидной лейкемий;
PML-RAR-а — гибридный ген, кодирующий рецептор ретиноевой кислоты а (RAR-а),
соединенный с белком PML (промиелоцитарная лейкемия).
В лимфоидных клетках протоонкогены активируются в результате ошибок во время перестройки и диверсификации генов антигенного рецептора. Потенциально онкогенные мутации наиболее часто возникают в В-клетках герминативного центра в процессе создания антител. После антигенной стимуляции в В-клетках возрастает экспрессия цитозиндезаминазы — особого ДНК-модифицирующего фермента, ответственного за два типа модификаций генов иммуноглобулина (Ig).
Первый тип — переключение класса Ig. Это внутригенный процесс рекомбинации, при котором генный сегмент, кодирующий константную область тяжелой цепи IgM, замещается другим константным сегментом (например, IgG3). Таким способом происходит переключение изотипа антител.
Второй тип — это соматические гипермутации, индуцирующие точечные мутации генов Ig, которые случайным образом могут повысить аффинность антител к антигену. Некоторые протоонкогены, например с-MYC, активируются в В-клетках герминативного центра в результате хромосомных транслокаций, захватывающих области переключения класса Ig. Для запуска процесса транслокации с-MYC/Ig в В-клетках герминативного центра достаточно экспрессии цитозиндезаминазы, вероятно из-за повреждения ДНК, приводящего к хромосомным разрывам. Заметим, что активации даже сильных онкогенов, например с-MYC, недостаточно, чтобы вызвать трансформацию: как и другие злокачественные опухоли, лимфомы возникают в результате множественных генетических нарушений.
Другие протоонкогены, например BCL6, чаще активируются в В-клетках герминативного центра в результате точечных мутаций, возникающих, видимо, вследствие ненаправленного действия цитозиндезаминазы. Разнообразие антител к инфекциям во многом компенсирует ущерб, наносимый потенциально онкогенными мутациями. Однако это слабое утешение для людей с наиболее частыми и клинически значимыми лимфоидными неоплазиями, представляющими собой опухоли из В-клеток герминативного центра. Второй тип модификаций генов Ig уникален для предшественников В- и Т-клеток, экспрессирующих V(D)J-рекомбиназу, которая «разрезает» ДНК в специфических участках в локусах Ig и Т-клеточного рецептора соответственно.
Этот процесс важен для образования продуктивных генов антигенных рецепторов, однако иногда он протекает неправильно, приводя к соединению фрагментов других генов с регуляторными элементами генов антигенных рецепторов. Такое нарушение регуляции, вызываемое протоонкогенами, особенно характерно для опухолей, источником которых служат предшественники Т-клеток.
б) Наследственные генетические факторы. У лиц с генетическими заболеваниями, способствующими геномной нестабильности, например синдромом Блума, анемией Фанкони и атаксией-телеангиэктазией, повышен риск развития острой лейкемии. Кроме того, с повышенной частотой развития лейкемии у детей ассоциируется синдром Дауна (трисомия по 21-й хромосоме) и нейрофиброматоз типа I.
в) Вирусы. При некоторых лимфомах этиологическими агентами считают три лимфотропных вируса: вирус Т-клеточной лейкемии человека типа 1 (HTLV-1), EBV и KSHV. Возможные механизмы трансформации, опосредуемой этими вирусами, обсуждены в отдельных статьях на сайте (рекомендуем пользоваться формой поиска выше). HTLV-1 ассоциируется с Т-клеточной лейкемией/лимфомой у взрослых. EBV обнаружен в подгруппе лимфом Беркитта, 30-40% лимфом Ходжкина, многих В-клеточных лимфомах, развивающихся в условиях Т-клеточного иммунодефицита, и редких NK-клеточных лимфомах. Помимо саркомы Калоши KSHV ассоциируется с необычной В-клеточной лимфомой, проявляющейся злокачественным выпотом, часто в полость плевры.
г) Хроническая иммунная стимуляция. Различные факторы окружающей среды, вызывающие хроническую местную иммунную стимуляцию, предрасполагают к лимфоидной неоплазии, источником которой почти всегда служит воспаленная ткань. Такова связь инфекции, вызываемой Н. pylori, с В-клеточной лимфомой желудка и глютенчувствительной энтеропатии с Т-клеточными лимфомами кишечника. В отличие от этого при ВИЧ-инфекции существует повышенный риск развития В-клеточных лимфом практически в любом органе. На ранних стадиях ВИЧ-инфекции Т-клеточная дисрегуляция вызывает системную гиперплазию В-клеток герминативного центра, ассоциированную с повышением частоты В-клеточных лимфом. При развитии СПИДа тяжелый Т-клеточный иммунодефицит еще больше повышает риск развития В-клеточных лимфом, особенно ассоциированных с EBV и KSHV.
д) Ятрогенные факторы. Радиотерапия и некоторые виды химиотерапии, используемые для лечения злокачественных опухолей, повышают риск развития миелоидных и лимфоидных неоплазий. Неоплазии возникают в результате мутагенного действия ионизирующего излучения и химиотерапевтических агентов на гематолимфоидные клетки-предшественники.
е) Курение. Частота острой миелоидной лейкемии у курящих лиц выше в 1,3-2 раза, предположительно вследствие действия канцерогенов, содержащихся в табачном дыме, например бензола.
- Рекомендуем ознакомиться со следующей статьей "Механизмы развития (патогенез) лимфоцитарного лейкоза и лимфомы"
Оглавление темы "Патогенез болезней":- Механизмы развития (патогенез) метастазов опухолей в сердце
- Механизмы развития (патогенез) осложнений трансплантации сердца
- Образование клеток крови (дифференцировка)
- Механизмы развития (патогенез) лейкопении и агранулоцитоза
- Механизмы развития (патогенез) лейкоцитоза
- Механизмы развития (патогенез) лимфаденита
- Механизмы развития (патогенез) неоплазий лейкоцитов
- Механизмы развития (патогенез) лимфоцитарного лейкоза и лимфомы
- Механизмы развития (патогенез) острого лимфоцитарного лейкоза
- Механизмы развития (патогенез) хронического лимфоцитарного лейкоза

