Молекулярные профили опухолей и их характеристика
До недавнего времени объектами исследований экспрессии генов были отдельные гены. Однако после появления методов, позволяющих изучать экспрессию всех генов генома одновременно, все изменилось. Сейчас для крупномасштабных исследований экспрессии генов наиболее часто используют технологию ДНК-микрочипирования. Существует два метода анализа чипов ДНК, каждый из них имеет свои преимущества и недостатки. Продукты ПЦР клонированных генов или олигонуклеотиды из генов, которые исследуют, наносят в виде пятен на стекло.
Чипы высокой плотности могут содержать более 2 млн элементов. Затем эти генные чипы гибридизируют с образцами, приготовленными из опухоли и контрольной ткани (образцы обычно представлены комплементарными ДНК-копиями РНК, экстрагированной из опухоли и пораженных тканей), меченными флуоро-хромом. Потом выполняют лазерное сканирование с высоким разрешением и регистрируют флуоресцентные сигналы, исходящие от каждого пятна. Затем с этими данными можно проводить разнообразные виды анализа.
Одним из наиболее полезных в онкологии является метод иерархической группировки, позволяющий оценить с многих точек зрения молекулярную гетерогенность и биологическое поведение опухоли. Можно определить профиль экспрессии опухолей с различными исходами, например рецидивирующий и нерецидивирующий рак молочной железы. Методом иерархической группировки выявлено небольшое (будем надеяться) количество генов, которыми и отличаются эти опухоли и по которым можно предсказать поведение опухолей.
Таким образом, есть надежда, что профили экспрессии генов позволят стратифицировать пациентов по риску и ответу на лечение на более высоком уровне и точнее, чем гистологическое исследование и стадирование опухоли. С помощью молекулярного анализа было установлено, что фенотипически идентичные крупноклеточные В-лимфомы у различных пациентов являются гетерогенными (относительно их генного выражения). Тем не менее на основании различий в экспрессии генов опухолей, имеющих одинаковый фенотип, опухоли можно разделить на подгруппы по выживаемости пациентов.
Большой проблемой в анализе экспрессии генов является гетерогенность опухолевой ткани, наличие в образцах соединительнотканной стромы, воспалительного инфильтрата и фрагментов нормальной ткани. Единственный выход из этой ситуации — получать «чистую» опухоль или маленькие ее части с помощью лазерной микродиссекции (опухолевые клетки вырезают сфокусированным лазером под микроскопом, материал помещают в небольшую пробирку и используют для выделения ДНК и РНК).
Использование молекулярного профиля опухолей будет расширяться и совершенствоваться, но кое-что уже сделано. Наиболее известные результаты касаются профиля экспрессии генов рака молочной железы. Помимо идентификации новых подтипов рака молочной железы были выявлены 70 сигнатурных мутаций генов, имеющих прогностическое значение. Установлено, что сигнатурные мутации — мощный предиктор заболевания у молодых женщин (особенно в прогнозировании метастазов в течение 5 лет после установления диагноза).
Прогноз, определенный по генетическому профилю экспрессии, хорошо коррелирует с гистологической классификацией и эстрогенным рецепторным статусом, но не коррелирует с лимфогенным распространением опухоли. В настоящее время для оценки риска рецидива и ответа на химиотерапию в группе женщин с раком молочной железы используют панель из 21 гена.
Развитие новых платформ для микрочипов и технологий, например высокопроизводительного секвенирования, позволяет создать классификацию всех генетических изменений в опухолевых клетках. Сравнительная геномная гибридизация на основе чипов дает возможность выявлять такие изменения генов, как амплификация и делеция, и сопоставлять с экспрессией генов. SNP-чипы, охватывающие весь геном, можно использовать для расширенного анализа генома и определения риска злокачественных опухолей. Тилинг-чип всего генома применяют для выявления новых транскриптов, промоторов и мест сплайсинга.
Тилинг-чип также может быть полезен в идентификации эпигенетических изменений, например метилирования ДНК, а в комбинации с техникой иммунопреципитации хроматина получают карту сайтов хроматиновых маркеров, а также мест связывания факторов транскрипции. Высокопроизводительное ресеквенирование, позволяющее генерировать сотни миллионов — миллиарды пар оснований за один цикл, помогает идентифицировать неизвестные химерные белковые продукты гибридных генов, а также осуществить эффективное ресеквенирование всего генома опухолевой клетки.
Новым горизонтом молекулярных технологий для глобального анализа злокачественных опухолей является протеомика — метод, позволяющий изучать профиль белков ткани, сыворотки крови и других жидкостей тела. Известно, что уровни мРНК регулируются посттрансляционно, но непонятно, каким образом уровень белков (молекул, участвующих в клеточных процессах) коррелирует с уровнями мРНК. В настоящее время развиваются такие технологии, как масс-спектроскопия и чипирование антител, позволяющие глобально изучать белки.
Развитие новых технологий глобального молекулярного анализа опухолей заставляет некоторых ученых предсказывать закат гистопатологии и считать существующие методы диагностики опухолей сродни колдовским гаданиям. Безусловно, невозможно игнорировать успехи экспериментальной медицины и новых мощных методов молекулярного анализа. Однако не всегда новый метод должен заменять старый. Напротив, наиболее точной диагностики злокачественных опухолей и исходов можно достичь использованием морфологических и молекулярных методов диагностики в комплексе.
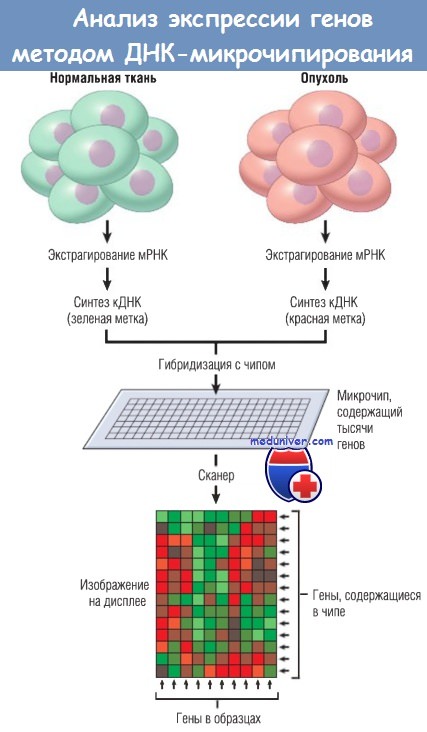
РНК экстрагируют из образцов нормальной и опухолевой тканей.
Для каждого образца синтезируют комплементарную ДНК (кДНК) с флуоресцентной меткой (в данном случае зеленые молекулы использовали для нормальной кДНК, а красные молекулы — для опухолевой кДНК).
Чип состоит из плотной стеклянной подложки с фрагментами ДНК из тысяч известных генов, нанесенными в виде пятен.
Меченые кДНК из опухоли и нормальной ткани смешивают, наносят на чип. Происходит гибридизация с чипом.
Флуоресцентные сигналы при сканировании чипа конфокальным лазером фиксируют и загружают в компьютер для анализа
(красные участки соответствуют более высокой экспрессии генов в опухолях, зеленые — более высокой экспрессии в нормальных тканях, черные означают отсутствие различий).
На дисплее все горизонтальные линии соответствуют генам, содержащимся в чипе; каждая вертикальная линия — одному образцу.
мРНК — матричная рибонуклеиновая кислота.
- Рекомендуем ознакомиться со следующей статьей "Маркеры опухоли - онкомаркеры"
Оглавление темы "Патофизиология":- Местное и гормональное действие опухоли
- Механизмы снижения веса при опухоли - опухолевой кахексии
- Паранеопластический синдром и его характеристика
- Классификация и стадирование опухолей TNM
- Лабораторная диагностика злокачественных опухолей легких
- Молекулярные профили опухолей и их характеристика
- Маркеры опухоли - онкомаркеры
- Классификация возбудителей инфекции - инфекционных агентов
- Методы выявления возбудителей инфекции (инфекционных агентов)
- Новые инфекционные болезни и их характеристика

