Схема организации иммунной системы человека
Организм располагает взаимосвязанными между собой механизмами неспецифической врожденной и специфической приобретенной, или адаптивной, иммунной защиты от микроорганизмов (бактерий, вирусов, грибов, паразитов), а также от чужеродных макромолекул. Фрагменты патогенов и высокомолекулярные чужеродные частицы представляют собой антигены, с которыми реагирует специфическая система защиты, характеризующаяся активацией и пролиферацией моноспецифических Т- и В-лимфоцитов (Т клеток и В-клеток).
В-клетки дифференцируются в плазматические клетки, которые продуцируют антитела (иммуноглобулины подклассов IgA, IgD, IgE, IgG, IgM). Их основные задачи: 1) нейтрализация, 2) опсонизация антигенов и 3) активация системы комплемента. Эти высокоспецифичные механизмы иммунной защиты служат для распознавания определенных антигенов, элиминация которых впоследствии завершается относительно неспецифическим путем. Кроме того, иммунная система обеспечивает «запоминание» антигенов посредством В-и Т-клеток памяти (иммунная память).
Созревание Т- и В-клеток происходит соответственно в тимусе и костном мозге. Из клеток-предшественниц лимфопоэза, изначально не имеющих рецепторов определенных антигенов, образуется более 108 различных видов моноспецифических лимфоцитов (каждый против определенного антигена). Девственные лимфоциты, пока еще не имеющие рецепторов определенного вида антигена, циркулируют по сосудистому и лимфатическому руслам. Когда они встречают «свой» антиген, а происходит это обычно в лимфоидной ткани, пролиферируют именно этого типа лимфоциты (клональная селекция и пролиферация).
В результате этого образуются многочисленные моноспецифические дочерние клетки. Они дифференцируются в эффекторные Т-клетки и плазматические клетки соответственно, которые участвуют в элиминации антигена.
Лимфоциты, имеющие на своей поверхности рецепторы компонентов собственных клеток организма, элиминируются несозревшими в тимусе и костном мозге после распознавания таких антигенов. Этот процесс клональной делеции составляет суть центральной иммуногенной толерантности. Иммунная система совершенствуется в перинатальный период и «учится» распознавать чужеродные и собственные антигены. В нормальных условиях антигены, с которыми контактировала иммунная система в ранние периоды жизни, впоследствии на протяжении всей жизни распознаются какэндогенные; все остальные антигены, с которыми произошел контакт позже, — как чужеродные.
При нарушении такого распознавания развиваются аутоиммунные (иммунные аутоагрессивные) болезни.
В редких случаях неспецифическая иммунная защита способна (например, при первом инфицировании вирусом кори) самостоятельно предупредить репликацию вируса и его распространение по организму, т. е. предотвратить развитие болезни. Специфическая иммунная защита, реализующаяся через действие Т-киллеров и иммуноглобулинов (в первую очередь IgM, во вторую — IgG), запускается в действие медленнее (первичный ответ, или сенсибилизация), но затем ее работа продолжается до обезвреживания патогена, т. е. коревая инфекция подавляется.
При повторной встрече с таким возбудителем синтез антител быстро переключается (на преимущественное образование IgG), т. е. развивается вторичный ответ, вирус мгновенно удаляется и повторное инфекционное заболевание не развивается (т. е. формируется стойкий иммунитет). (Первичный ответе формированием иммунитета также можетбыть достигнут с помощью иммунизации антигеном соответствующего возбудителя [активная иммунизация].)
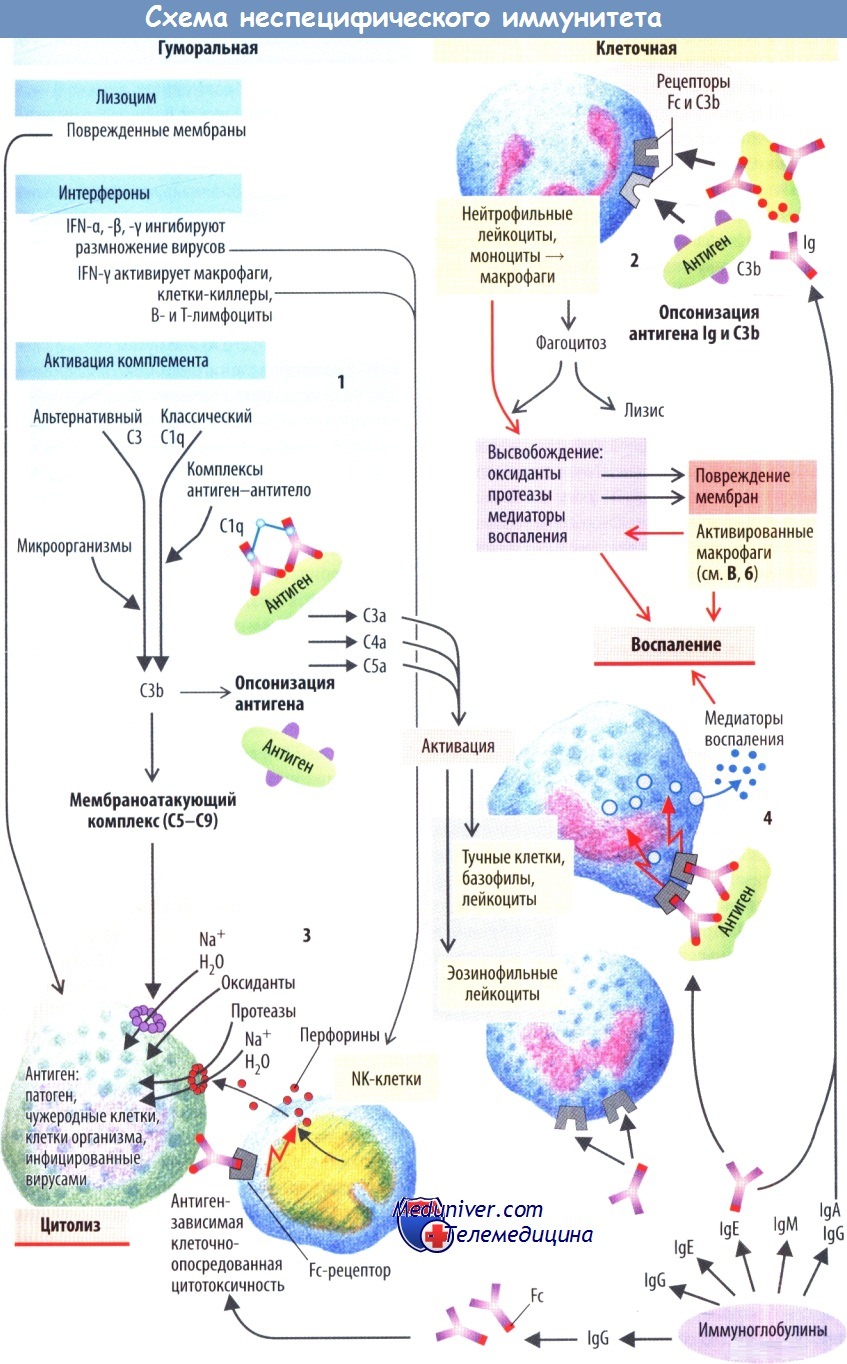
Неспецифическая защита осуществляется с помощью растворимых, или гуморальных, защитных веществ, например лизосомных ферментов и компонентов системы комплемента, а также фагоцитов, в особенности макрофагов (которые образуются в тканях из попавших в них моноцитов), и нейтрофильных лейкоцитов, или нейтрофилов. Нейтрофилы, как и моноциты и эозинофильные лейкоциты (эозинофилы), образуются в костном мозге. После этого они распределяются по всему организму, а затем под влиянием хемокинов осуществляют свое направленное движение к месту скопления патогенов (хемотаксис). Далее они запускают воспалительный процесс посредством выделения соответствующих медиаторов.
Фагоциты захватывают патоген (эндоцитоз) либо вовлекают его в своеобразную внеклеточную сеть из псевдоподий, после чего повреждают патоген (особенно после его активации; см. далее и -»В, 6) с помощью лизосом, оксидантов, таких как пероксид водорода (Н202) и радикалы кислорода (О2-, ОН-, О2), монооксид азота (NО) и др., а затем переваривают патоген с помощью лизосомных ферментов (лизис). Если размеры антигена слишком большие (например, в случае червей-паразитов), указанные выше защитные вещества также выделяются во внеклеточное пространство (экзоцитоз, в данном примере преимущественно реагируют эозинофилы).
В обычных условиях концентрация таких оксидантов поддерживается на невысоком уровне благодаря действию восстанавливающих их ферментов (каталазы, супероксиддисмутазы). При активации фагоцитов такое «сдерживание» нарушается, поэтому бактерицидное действие оксидантов проявляется в полную силу; фагоциты сами по себе могут обладать выраженной бактерицидной активностью, даже если другие клетки иммунной защиты по каким-либо причинам недостаточно активны.
После того как поверхность антигена «нашпигована» IgM, IgG или компонентами комплемента С3b (опсонизация), фагоцитоз и переваривание лизосомами усиливаются (фагоцитируются бактерии, имеющие липополисахаридную капсулу). Фагоциты содержат рецепторы антигеннезависимых фрагментов Fc иммуноглобулинов, а также СЗЬ, с помощью которых они прикрепляются к опсонизированному антигену (эти рецепторы особенно важны для связывания с антигеном Т1; см. далее). С помощью этого механизма фагоцитоз, который по сути является неспецифической защитной реакцией, участвует в специфической иммунной защите. Более того, белок, связывающий маннозу, который соединяется с группами маннанов (полимеров маннозы) на поверхности бактерий и некоторых вирусов, как оказалось, обладает опсонизирующими свойствами и действует как неспецифическое антитело.
Помимо этого патогены, которые опсонизируются иммуноглобулинами (так называемый классический путь), а также патогены, которые не опсонизируются (альтернативный путь), и, возможно, белок, связывающий маннозу, запускают каскад системы комплемента. Итогом этой активации становится образование мембраноатакующего комплекса, состоящего из компонентов комплемента С5— С9. Этот комплекс встраивается в наружную стенку (грамотрицательных) бактерий, вызывая их гибель. В это же время лизоцим (присутствующий также в плазме, лимфе и различных секретах) разрушает клеточную стенку бактерий ферментативным путем (цитолиз). Другими компонентами врожденной иммунной системы являются Toll-подобные рецепторы (TLR1—TLR11). Они экспрессируются на поверхности мембраны макрофагов, дендритных клеток, энтероцитов и эпителиальных клеток почечных канальцев.
Эти рецепторы распознают определенные компоненты (PAMPS — молекулярные образцы, ассоциированные с патогенами) различных патогенов и запускают каскад внутриклеточных сигнальных путей, приводящих к формированию защиты организма (например, к NFкВ-зависимому синтезу дефенсинов, см. далее). TLR2 распознает бактериальныелипопротеиды, TLR7 — спиральодноцепочечной РНК (ssRNA), TLR9 — бактериальную ДНК (цитозин-фосфатидил-гуанозиновые островки) и TLR11 — бактерии, относящиеся к уропатогенному штамму Escherichia coli. Дефенсины представляют собой пептиды (в состав которых входит приблизительно 30 аминокислотных остатков), высвобождающиеся из макрофагов и энтероцитов и оказывающие (например, путем образования ионных каналов в мембране клеток-мишеней) неспецифическое цитотоксическое действие, повреждая даже патогены, устойчивые к влиянию NK-клеток.
Эти так называемые естественные киллеры (NK-клетки) специализируются на неспецифической защите, особенно против вирусов, микобактерий и опухолевых клеток. Они распознают свои «жертвы» (патогены, клетки, инфицированные вирусами, или опухолевые клетки), обнаруживая их чужеродную поверхность (на ней отсутствуют родные для организма молекулы HLA) или путем связывания своих Fc-рецепторов с антигенами, опсонизированными IgG, на поверхности клеток «жертвы» (антигензависимая клеточно-опосредованная цитотоксичность). В каждом случае киллерные клетки перфорируют мембрану «жертвы» с помощью выделяемых путем экзоцитоза перфоринов и таким образом вызывают гибель атакованных ими клеток (цитолиз). Такой механизм защиты не только подавляет способность к размножению проникших в организм вирусов (воздействуя на клеточные ферментные системы), но и снижает устойчивость выживших вирусов и других внутриклеточных патогенов к действию других защитных систем. NK-клетки активируются интерферонами (IFN), особенно IFN-а и IFN-$, которые высвобождаются излейкоцитов и макрофагов, а также IFN-y, выделяющимся из активированных Т-лимфоцитов и из самих NK-клеток. Интерфероны, которые выделяют инфицированные клетки, также повышают противовирусную устойчивость пока еще не инфицированных клеток.
Макрофаги образуются из моноцитов, которые либо попали, либо находятся в каком-либо месте (при этом имеют возможность быстро покидать его), К таким местам относятся синусы печени (купферовские клетки), альвеолы легких, синусы селезенки, поверхность брюшины, лимфатические узлы, кожа (клетки Лангерганса), суставы (синовиальные А-клетки), мозг (микроглия) и эпителий (в частности, почечных клубочков). Все вместе они относятся к мононуклеарной фагоцитарной системе или ретикулоэндотелиаль-ной системе. Макрофаги способны распознавать относительно неспецифические углеводные остатки на поверхности бактерий, фагоцитировать и переваривать их. Для того чтобы взаимодействовать с патогенами, способными выживать в фагосомах, макрофаги должны активироваться.
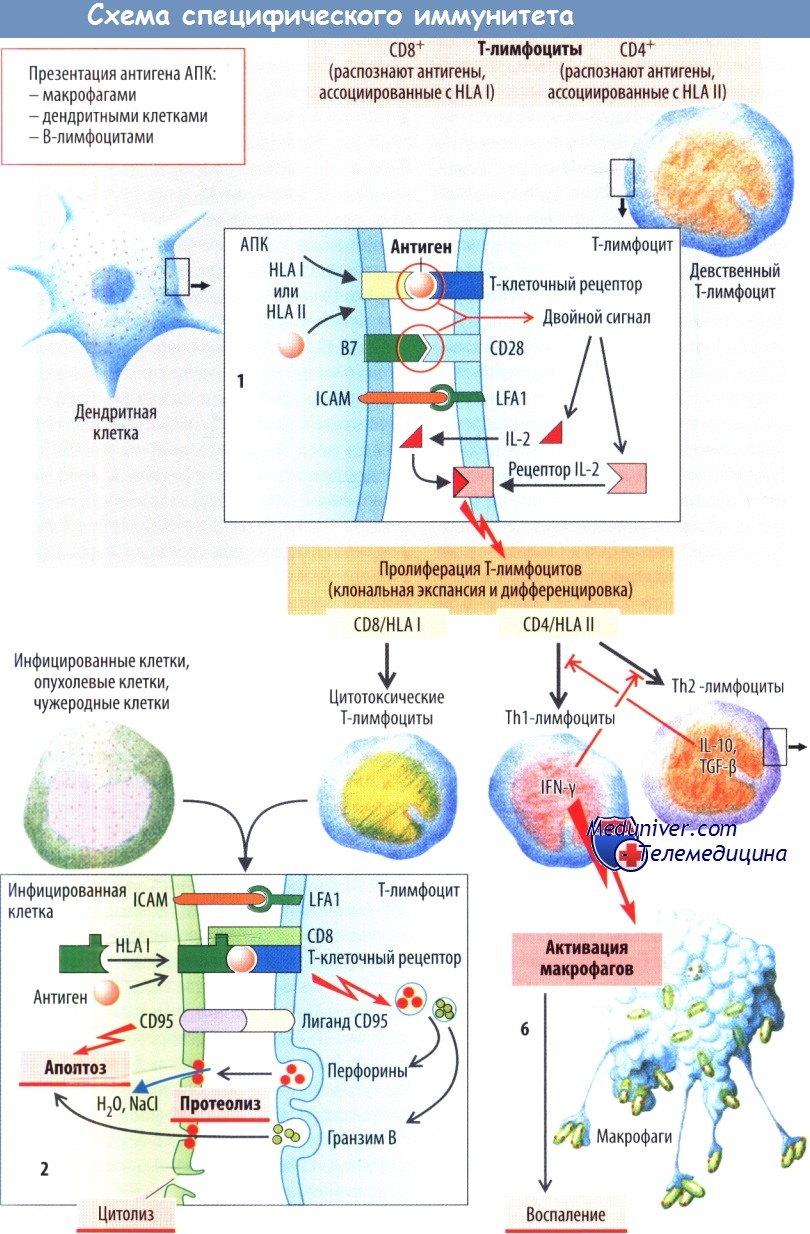
Специфические клеточно-опосредованные механизмы иммунной защиты, которые реализуются с участием Т-лимфоцитов и активируются относительно медленно (в течение нескольких суток [замедленный иммунный ответ]), предполагают, что переработанный антиген (фрагменты пептида) представляется проходящим мимо девственным Т-клеткам «профессиональными» антигенпредставляющими клетками (АПК). В результате антиген связывается с молекулами МНС I и II классов, которые у человека также называются HLAI или II класса соответсвенно. К наиболее важным АПК относятся дендритные клетки, которые обнаруживаются главным образомлимфоидной ткани, но также присутствуют в слизистой оболочке кишечника.
На рисунке показано, как молекулы клеточной адгезии ICAM, присутствующие на поверхности АПК, взаимодействуют LFA1 (антигеном 1, связанным с функцией лимфоцитов) на мембране Т-лимфоцита. Когда с антигеном связывается Т-лимфоцит, специфичный для этого антигена, степень соединения усиливается и Т-лимфоцит активируется двойным сигналом, запускающим процесс клональной селекции. Этот двойной сигнал состоит из 1) распознавания антигена (связанного с HLA I или HLA II) рецептором Т-лимфоцита с его корецептором [цитотоксических Т-клеток CD8 и Т-хелперов CD4; и долее]) и 2) костимуляционного сигнала, т. е. связывания белка В7 (присутствующего на АПК) с белком лимфоцита CD28. (Если связывание антигена происходит без костимуляции [например, в печени, где обычно нет АПК], лимфоциты фактически инактивируются, т.е. становятся анергичными [периферическая иммунная толерантность].)
Т-лимфоциты также могут получить двойной сигнал АПК от инфицированных макрофагов или от В-лимфоцитов, которые захватили своими рецепторами антиген (например, яды насекомых или змей, аллергены). Двойной сигнал АПК запускает экспрессию IL-2 Т-лимфоцитами, а также процесс включения рецептора IL-2 в клеточную мембрану. IL-2 (или IL-4, IL-7, IL-15) служит важным (аутокринным или паракринным) сигналом для клональной экспансии этих моноспецифическихТ-лимфоцитов. При клональной экспансии Т-лимфоциты дифференцируются в три типа активных клеток (Т-киллеры, Тh1 и Th2), которые больше не нуждается в костимуляции и экспрессируют новые молекулы клеточной адгезии (VLA-4 вместо L-селектинов). Затем эти клетки прикрепляются кэндотелию в тканях, где протекает воспаление (но не в лимфоидныхтканях, где находятся их материнские девственные клетки). О важности сигналов от интерлейкинов также можно судить по следующему факту: ингибиторы интерлейкинов, такие как циклоспорин А или рапамицин, служат высокоэффективными иммунодепрессантами (например, при трансплантации органов).
Цитотоксические Т-клетки (Т-киллеры) образуются из девственных Т-лимфоцитов CD8 после представления антигена, ассоциированного с HLA I. HLA I чаще связывается с антигенами из цитоплазмы (вирусы, белки цитоплазмы, эндогенные антигены). Через их CD8-ассоциированные Т-клеточные рецепторы цитотоксические Т-клетки распознают связанные с HLAI антигены на поверхности инфицированных (вирусом) клеток организма, опухолевых клеток, клеток пересаженных органов и уничтожают эти клетки.
Перфорины образуют поры, через которые внутрь клеток попадает гранзим В (протеаза) и вызывает их гибель в результате как апоптоза, так и цитолиза. Помимо этого апоптоз клеток-мишеней также происходит вследствие связывания лиганда CD95, присутствующего на Т-лимфоцитах, с CD95 (= Fas), имеющегося на поверхности клеток-мишеней.
После HLA II-ассоциированного представления антигена (антиген из внутриклеточных везикул, например антигены фагоцитированных бактерий или белки вирусной оболочки) Т-лимфоциты CD4 превращаются в незрелые эффекторные Т-клетки (ThO). Далее они дифференцируются в Т-хелперы: либо в воспалительные Т-клетки (Th1), которые активируют макрофаги с помощью IFN-y, либо в Т-хелперы 2-го типа (Th2), которые необходимы для активации В-лимфоцитов. Эти два типа клеток ингибируют активность друг друга [супрессия), поэтому обычно наблюдается преобладание какого-то одного типа.
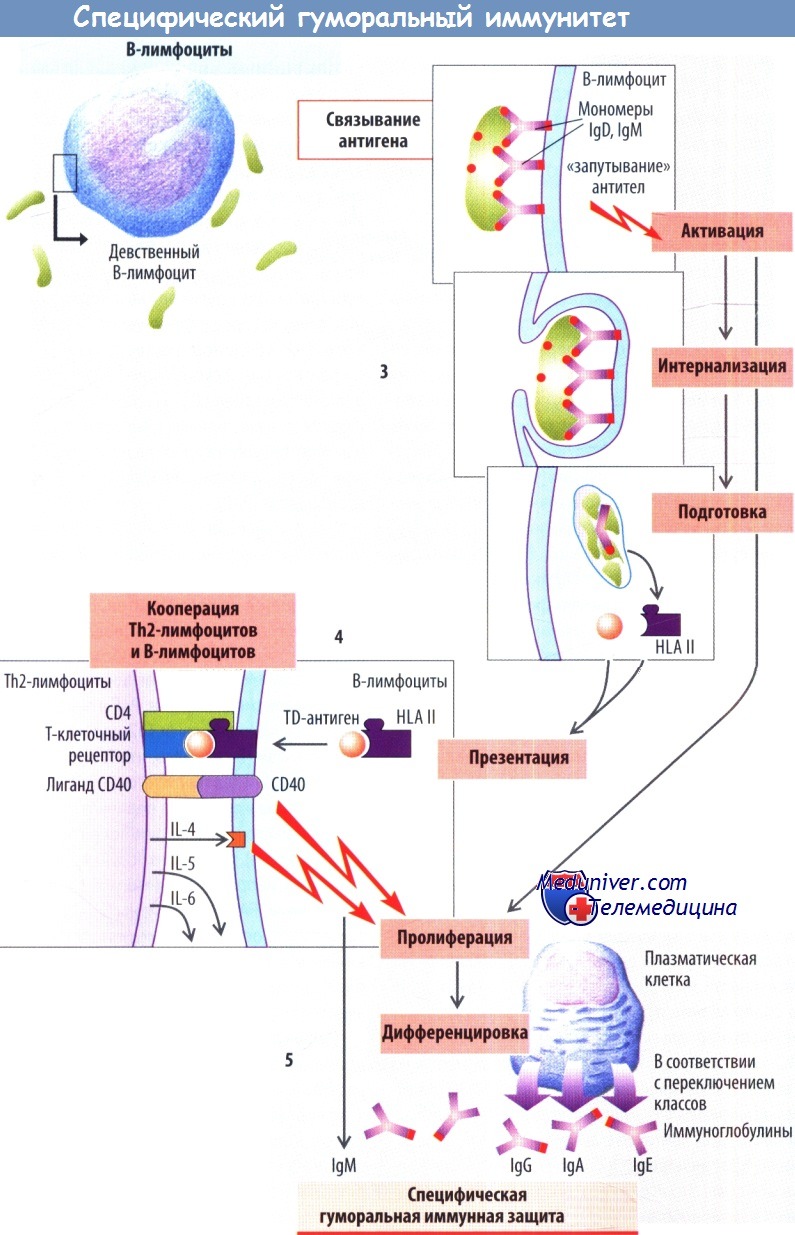
Специфическая гуморальная иммунная защита опосредована действием В-лимфоцитов. На их поверхности фиксированы IgD и мономеры IgM (еще имеется растворимый IgM в форме пентамеров); некоторые из них связываются с определенными антигенами. Появляющаяся в результате связь между антигеном и антителом вызывает интернализацию и процессинг комплекса антиген — антитело. Однако для последующей активации В-лимфоцитов необходим второй сигнал. В случае контакта с так называемыми тимуснезависимыми антигенами этот сигнал может быть следствием действия собственно антигенов (в частности, бактериальных липополисахаридов).
В случае контакта с тимусзависимым антигеном (TD) второй сигнал вызывают Th2-клетки, которым В-лимфоциты представляют TD-антиген, ассоциированный с молекулами HLA II. После того как Т-клеточный рецептор Th2 распознает анти ген, на поверхности Th2-клеток экспрессируется лиганд CD40 (который связывается с белком CD40 на поверхности В-лимфоцита) и секретируется IL-4. Лиганд CD40 и IL-4 (а позднее IL-5 и IL-6) запускают клональную селекцию В-лимфоцитов, продуцирование ими моноспецифических IgM и дифференцировку этих В-лимфоцитов в плазматические клетки. В зависимости от кода Fc-области (переключение классов) плазматические клетки образуют IgA, IgG или IgE таким образом, что все иммуноглобулины, основанные определенным клоном В-клеток, являются специфичными для одного и того же антигена.
- Рекомендуем ознакомиться со следующей статьей "Схема развития воспаления"
Оглавление темы "Патофизиология в схемах":- Схема развития мегалобластной анемии (В12-дефицитной анемии, анемии дефицита фолиевой кислоты)
- Схема развития анемии при нарушении синтеза гемоглобина
- Схема развития железодефицитной анемии
- Схема развития гемолитической анемии
- Схема организации иммунной системы человека
- Схема развития воспаления
- Схема развития аллергии - рекции гиперчувствительности первого типа
- Схема развития аллергической рекции второго типа (цитотоксического)
- Схема развития аллергической рекции третьего типа (иммунокомплексного)
- Схема развития аллергической рекции четвертого типа (замедленного)

