Этапы заживления кожной раны
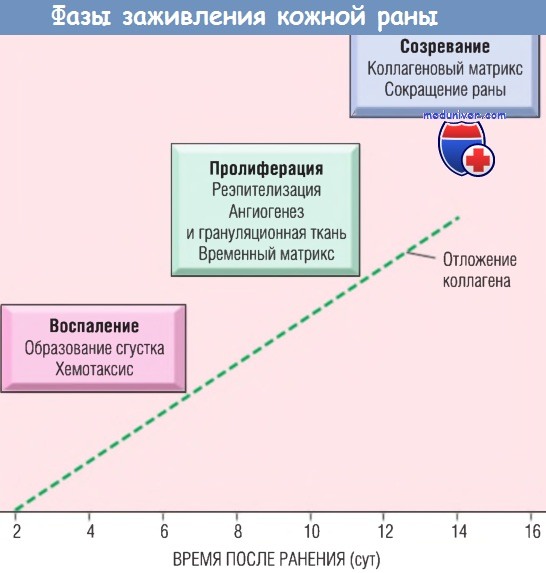
Процесс заживления кожных ран проходит три фазы: воспаление, пролиферацию и созревание. Поскольку фазы перекрываются, их разделение несколько условно, но это помогает понять последовательность событий, происходящих при заживлении кожных ран. Первоначально травма вызывает адгезию и агрегацию тромбоцитов и образование кровяного сгустка на поверхности раны, что приводит к развитию воспаления.
В фазу пролиферации происходят формирование грануляционной ткани, пролиферация и миграция клеток соединительной ткани и реэпителизация раневой поверхности. Созревание включает синтез ВКМ, ремоделирование ткани и сокращение раны.
Самый простой вид восстановления целостности кожного покрова — заживление чистого, неинфицированного хирургического разреза, края которого соединены с помощью швов. Этот процесс называют первичным заживлением или заживлением первичным натяжением. Разрез вызывает лишь местное нарушение целостности базальной мембраны эпителия и смерть относительно немногих эпителиальных и соединительнотканных клеток. Реэпителизация при закрытии небольшой раны происходит с образованием тонкого рубца. При обширных ранах, приводящих к большому дефекту поверхности кожи и, соответственно, к значительной потере клеток и тканей, процесс репарации более сложен.
Заживление таких ран сопровождается интенсивной воспалительной реакцией, образованием большого количества грануляционной ткани и отложением коллагена, что приводит к формированию значительного рубца и сокращению раны. Этот процесс называют вторичным заживлением или заживлением вторичным натяжением. Несмотря на эти различия, основные механизмы первичного и вторичного заживления схожи между собой. Их общие и отличительные черты описаны далее.
В заживлении кожных ран участвует большое количество факторов роста и цитокинов. Основные из них, а также этапы, в которых они принимают участие, приведены в таблице ниже. Далее мы обсудим последовательность событий при заживлении ран.
а) Формирование кровяного сгустка. Ранение вызывает быструю активацию коагуляции, приводящую к образованию кровяного сгустка на раневой поверхности. Помимо захваченных эритроцитов сгусток содержит фибрин, фибронектин и компоненты системы комплемента.
Основной функцией кровяного сгустка является остановка кровотечения, также он служит основой для миграции клеток, привлекаемых в очаг с помощью факторов роста, цитокинов и хемокинов в очаге. Выделение VEGF приводит к повышению сосудистой проницаемости и отеку. На внешней поверхности кровяного сгустка происходит дегидратация, образуется корка, покрывающая рану. Чем больше тканный дефект, тем больше фибриновый сгусток, больше экссудата и некротических остатков. В течение 24 час на краях разреза появляются нейтрофилы, используя сгусток в качестве каркаса. Они выделяют протеолитические ферменты, которые удаляют некротические остатки и бактерии.

б) Образование грануляционной ткани. В течение первых 24-72 час процесса репарации идет пролиферация эндотелиальных клеток сосудов с образованием грануляционной ткани, что является признаком репарации ткани. Ткань получила свое название из-за розовой, мягкой, гранулированной поверхности раны. Ее характерная гистологическая особенность — наличие новых мелких кровеносных сосудов (ангиогенез) и пролиферация фибробластов.
Стенки этих новых сосудов неплотные и позволяют белкам плазмы и жидкости просачиваться во внесосудистое пространство, поэтому новая грануляционная ткань часто отечна. Грануляционная ткань постепенно заполняет пространство раны. Количество образовавшейся грануляционной ткани зависит от размера раневого дефекта и интенсивности воспаления. Таким образом, грануляционная ткань более заметна при вторичном заживлении. Через 5-7 сут грануляционная ткань заполняет область раны, а степень неоваску-ляризации максимальна.
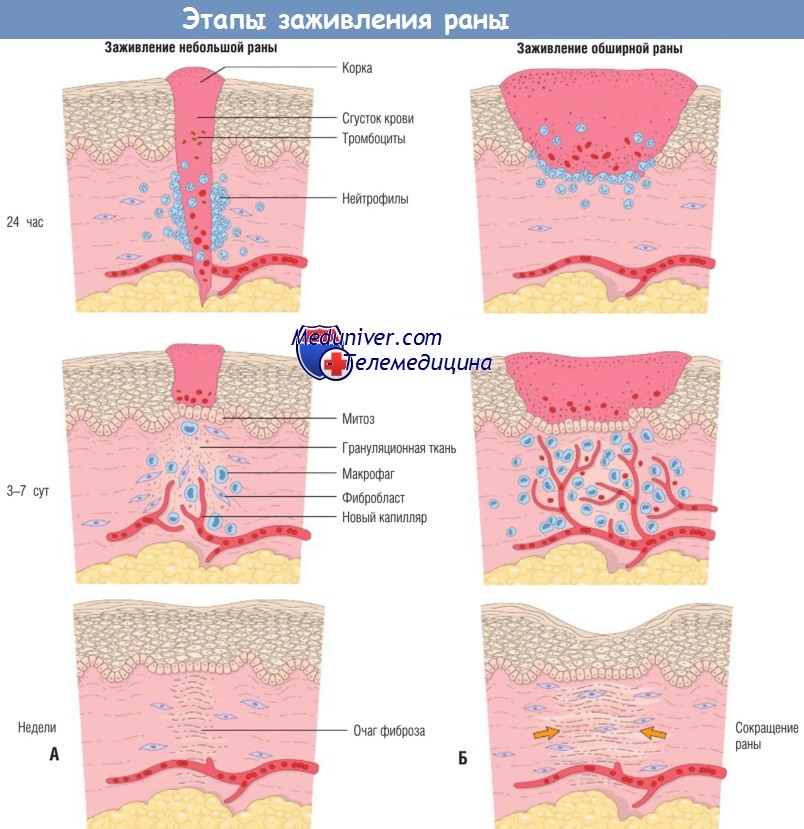
(А) Заживление небольшой раны: небольшое количество грануляционной ткани и образование тонкого рубца с минимальным сокращением раны.
(Б) Заживление обширной раны: большое количество грануляционной ткани и образование рубца, а также сокращение раны.
в) Клеточная пролиферация и отложение коллагена. Через 48-96 час нейтрофилы в значительной степени замещаются макрофагами — ключевыми клеточными элементами при репарации ткани, которые способствуют ангиогенезу, синтезу и ремоделированию ВКМ и удаляют продукты распада клеток, фибрин и другие чужеродные вещества в месте репарации.
Миграция фибробластов к месту повреждения обусловлена хемокинами, TNF, PDGF, TGF-b и FGF. Последующая пролиферация фибробластов стимулируется многими факторами роста, в т.ч. PDGF, EGF, TGF-b, FGF, и цитокинами IL-1 и TNF. Макрофаги являются основным источником этих факторов, хотя другие клетки воспаления и тромбоциты также могут их продуцировать. На этой стадии роста коллагеновые волокна присутствуют в краях разреза, но сначала они ориентированы вертикально и не имеют мостиков через разрез.
Через 24-48 час отростки эпителиальных клеток начинают двигаться от краев раны (сначала с небольшой пролиферацией клеток) вдоль рассеченных краев дермы, откладывая компоненты базальной мембраны. Они сливаются по средней линии под поверхностью корки, образуя тонкий непрерывный эпителиальный слой, закрывающий рану. При вторичном заживлении полная эпителизация раневой поверхности происходит гораздо медленнее, т.к. разрыв, который необходимо соединить, намного больше. Затем слой эпидермиса утолщается за счет пролиферации клеток эпителия. Макрофаги стимулируют продукцию фибробластами FGF-7 (фактора роста кератиноцитов) и IL-6, усиливающих миграцию и пролиферацию кератиноцитов.
Другими регуляторами реэпителизации являются HGF и гепаринсвязывающий EGF-подобный фактор роста. Сигналы, передаваемые через хемокиновый рецептор CXCR3, также способствуют реэпителизации кожи.
Одновременно с процессом эпителизации увеличивается количество коллагеновых волокон и они начинают соединять края разреза. Вначале временный матрикс содержит фибрин, фибронектин плазмы и коллаген типа III, затем происходит замещение матриксом, состоящим преимущественно из коллагена типа I. TGF-b является наиболее важным фиброгенным агентом. Он образуется большинством клеток грануляционной ткани и вызывает миграцию и пролиферацию фибробластов, усиление синтеза коллагена, фибронектина и уменьшение деградации ВКМ металлопротеиназами. Восстанавливаются нормальная толщина и структура эпидермиса, и происходит поверхностная кератинизация.
г) Образование рубца. Лейкоцитарная инфильтрация, отек и повышенная сосудистая проницаемость в основном исчезают в течение второй недели. Рана становится бледной, что сопровождается повышенным накоплением коллагена в очаге и регрессом сосудов. В итоге грануляционная ткань заменяется на бледный, аваскулярный рубец, состоящий из веретенообразных фибробластов, плотного коллагена, фрагментов эластической ткани и других компонентов ВКМ. Придатки кожи, уничтоженные по линии разреза, утрачиваются безвозвратно, хотя у крыс могут развиваться новые волосяные фолликулы на месте больших ран при стимуляции WNT. Этот пример показывает, что при соответствующем лечении восстановление придатков кожи при заживлении раны может быть достигнуто и у людей. К концу первого месяца из бесклеточной соединительной ткани, свободной от воспалительного инфильтрата и покрытой интактным эпидермисом, образуется рубец.
д) Сокращение раны. При обширных поверхностных ранах обычно происходит их сокращение, что характерно для вторичного заживления ран. Сокращение раны идет за счет уменьшения промежутка между ее кожными краями, а также площади раневой поверхности. Начальный этап сокращения раны связан с образованием на ее краю сети миофибробластов, экспрессирующих а-актин гладких мышц и виментин. Эти клетки имеют ультраструктурные характеристики клеток гладких мышц, сокращаются в ране и могут производить большое количество компонентов ВКМ — коллагена типа I, тенасцина С, остеонектина и внешнего домена фибронектина. Миофибробласты образуются из тканевых фибробластов под действием PDGF, TGF-b и FGF-2, выделяемых макрофагами в месте раны, а также они могут происходить из клеток-предшественников костного мозга, известных как фиброциты, или из эпителиальных клеток в процессе эпителиально-мезенхимального перехода.
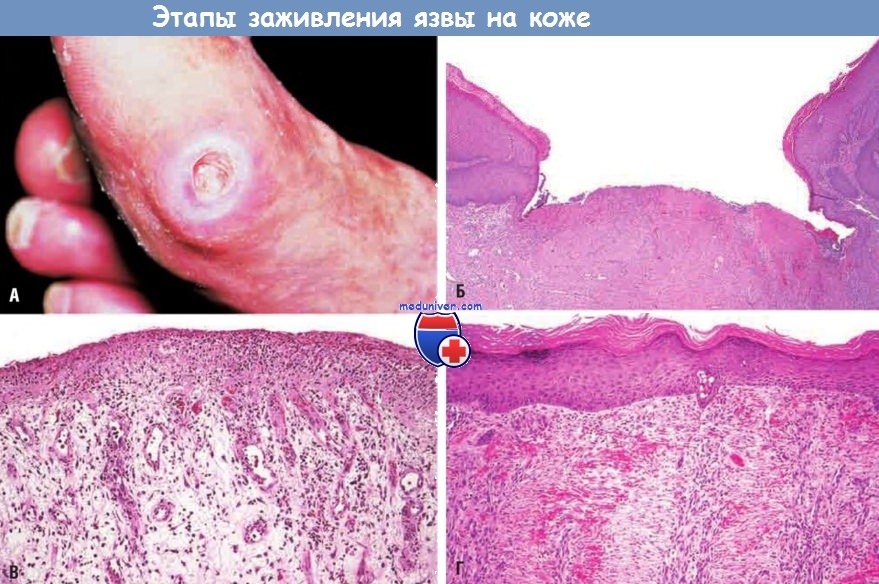
(А) Трофические язвы на коже обычно встречаются у больных сахарным диабетом.
На гистологических срезах показаны: кожная язва с большим расстоянием между краями раны (Б);
тонкий слой реэпителизации эпидермиса и образование обширной грануляционной ткани в дерме (В);
продолжающаяся реэпителизация эпидермиса и сокращение раны (Г)
е) Ремоделирование соединительной ткани. Замена грануляционной ткани рубцом влечет за собой изменения в структуре ВКМ. Баланс между синтезом и деградацией ВКМ приводит к ремоделированию структуры соединительной ткани — важной особенности репарации ткани. Некоторые из факторов роста, стимулирующие синтез коллагена и других молекул соединительной ткани, также регулируют синтез и активность металлопротеиназ — ферментов, разрушающих компоненты ВКМ.
Деградация коллагена и других белков ВКМ осуществляется ММР — семейством ферментов, включающим более 20 членов, которые имеют цинкпротеазный домен из примерно 180 остатков (ММР следует отличать от эластазы нейтрофилов, катепсина G, кининов, плазмина и других важных протеолитических ферментов, также разрушающих компоненты ВКМ и являющихся сериновыми протеиназами, а не металлоферментами). Матриксные металлопротеиназы включают: коллагеназы-1, -2 и -3 (ММР-1, -8, -13), расщепляющие фибриллярный коллаген типов I, II и III; желатиназы (ММР-2 и -9), разрушающие как коллаген базальных мембран, так и фибронектин; строме-лизины (ММР-3, -10 и -11), действующие на различные компоненты ВКМ, в т.ч. протеогликаны, ламинин, фибронектин и аморфные коллагены; семейство мембраносвязанных металлопротеиназ ADAM, описанное далее.
ММР продуцируются фибробластами, макрофагами, нейтрофилами, синовиальными и некоторыми эпителиальными клетками. Секреция ММР индуцируется факторами роста (PDGF, FGF), цитокинами (IL-1, TNF), фагоцитозом в макрофагах и тормозится TGF-b и стероидами. Коллагеназы расщепляют коллаген в физиологических условиях и синтезируются в виде латентного предшественника (проколлагеназы), который активируется химическими веществами, например свободными радикалами, образующимися в процессе окислительного стресса лейкоцитов, и протеиназами (плазмином). Образовавшись, активированные коллагеназы быстро ингибируются семейством специфических тканевых ингибиторов металлопротеиназ, продуцируемых многими мезенхимальными клетками.
Это предотвращает неконтролируемые эффекты этих протеаз. Коллагеназы и их ингибиторы имеют большое значение при санации очагов повреждения и ремоделировании соединительной ткани, необходимой для репарации.
ADAM — большое и важное семейство ферментов, связанных с ММР (семейство с дезинтегриновым и металлопротеиназным доменом). Большинство членов семейства ADAM крепятся на поверхности клетки с помощью одного трансмембранного домена клеточной поверхности. ADAM-17 (также известный как ТАСЕ для TNF-превращающего фермента) расщепляет мембраносвязанные предшественники TNF и TGF-a, высвобождая активные молекулы. Дефицит ADAM-17 приводит к эмбриональной или неонатальной гибели, связанной с гипоплазией легких. Члены семейства ADAM также принимают участие в патогенезе бронхиальной астмы и тромботических ми-кроангиопатий.
ж) Восстановление прочности раны на разрыв. Фибриллярные коллагены (главным образом коллагены типа I) образуют основную часть соединительной ткани на участках репарации и необходимы для восстановления прочности заживающих ран. Однако общее количество отложенного коллагена определяется не только увеличением его синтеза, но и уменьшением его деградации. Сколько времени понадобится кожной ране для обретения максимальной прочности? Когда удаляют швы (как правило, в конце первой недели), прочность раны составляет примерно 10% от прочности неповрежденной кожи. Прочность раны быстро растет в последующие 4 нед, замедляясь примерно на третьем месяце после операции, и достигает плато примерно на уровне 70-80% прочности неповрежденной кожи. Сниженная прочность в месте зажившей раны может сохраниться на всю жизнь.
В течение первых 2 мес восстановление прочности достигается за счет преобладания синтеза коллагена над его деградацией, а в более поздние сроки (после прекращения синтеза коллагена) — путем структурной перестройки волокон коллагена (перекрестного связывания, увеличения размера волокон).
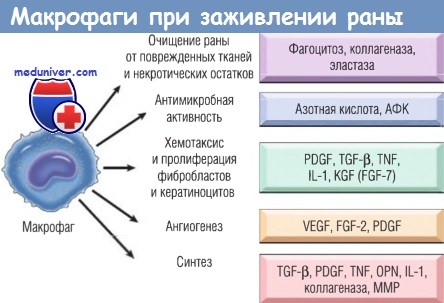
Макрофаги участвуют в очищении раны от поврежденных тканей и некротических остатков, обладают антимикробной активностью,
стимулируют хемотаксис и активацию клеток воспаления и фибробластов, вызывают ангиогенез,
а также стимулируют ремоделирование и синтез матрикса.
FGF-2 — основной фактор роста фибробластов; IL — интерлейкин; KGF — фактор роста кератиноцитов;
ММР — матриксные металлопротеиназы; OPN — остеопонтин; PDGF — тромбоцитарный фактор роста;
TGF — трансформирующий фактор роста; TNF — фактор некроза опухоли;
VEGF — сосудистый эндотелиальный фактор роста; АФК — активные формы кислорода; ВКМ — внеклеточный матрикс.
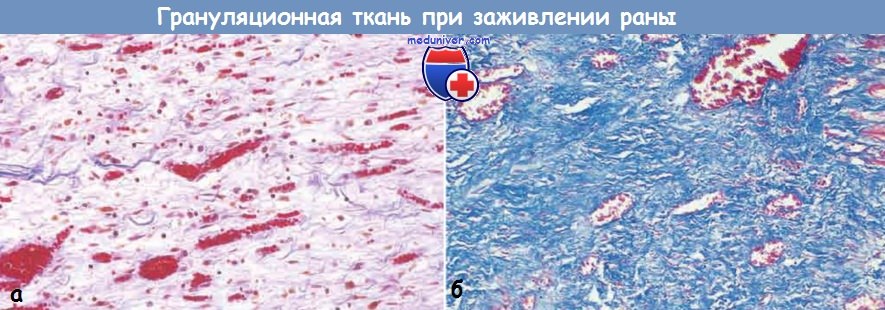
Коллаген окрашен в синий цвет (окрашивание трихромом); видно минимальное количество зрелого коллагена.
(Б) Зрелый рубец; виден плотный коллаген с редко встречающимися кровеносными сосудами (окрашивание трихромом).
- Рекомендуем ознакомиться со следующей статьей "Факторы влияющие на скорость заживления раны"
Оглавление темы "Патофизиология заживления тканей":- Эластин и фибриллин межклеточного вещества (внеклеточного матрикса)
- Белки клеточной адгезии межклеточного вещества (внеклеточного матрикса)
- Гликозаминогликаны и протеогликаны межклеточного вещества (внеклеточного матрикса)
- Этапы заживления ткани путем репарации
- Механизмы ангиогенеза в тканях и ее типы
- Сосудистый фактор роста и рецепторы в регуляции ангиогенеза
- Участие белков межклеточного вещества в регуляции ангиогенеза
- Этапы заживления кожной раны
- Факторы влияющие на скорость заживления раны
- Причины нарушений заживления раны (репарации)

