Механизм развития (патогенез) аутоиммунного гастрита
Аутоиммунный гастрит составляет менее 10% всех наблюдений хронического гастрита. В отличие от гастрита, вызванного H. pylori, аутоиммунный гастрит обычно не затрагивает антральный отдел желудка и сопровождается гипергастринемией. Для аутоиммунного гастрита характерны:
- наличие в сыворотке крови и желудочном соке антител к париетальным клеткам и внутреннему фактору;
- снижение концентрации пепсиногена I в сыворотке крови;
- гиперплазия эндокринных клеток в антральном отделе желудка;
- дефицит витамина В12;
- нарушение секреции соляной кислоты в желудке (ахлоргидрия).
а) Патогенез. Аутоиммунный гастрит сопровождается утратой париетальных клеток, которые ответственны за секрецию соляной кислоты и внутреннего фактора. Отсутствие продукции соляной кислоты стимулирует выделение гастрина, что приводит к гипергастрине-мии и гиперплазии гастринпродуцирующих G-клеток в антральном отделе желудка.
Отсутствие внутреннего фактора приводит к нарушению всасывания в подвздошной кишке витамина В12, что, в свою очередь, ведет к его дефициту и развитию мегалобластной анемии (пернициозной анемии). Снижение концентрации пепсиногена I в сыворотке является результатом разрушения главных клеток. Необходимо отметить, что Н. pylori может вызвать гипохлоргидрию, но никогда не вызывает ахлоргидрию и не сопровождается пернициозной анемией, поскольку повреждение париетальных и главных клеток при хеликобактер-ассоциированном гастрите не такое сильное, как при аутоиммунном гастрите.
Ранее считали, что в патогенезе аутоиммунного гастрита определенную роль играют аутоантитела к компонентам париетальных клеток, прежде всего к Н+/К+-АТФазе (протонной помпе) и внутреннему фактору. Однако это маловероятно, поскольку ни внутренний фактор, ни расположенная на люминальной поверхности клеток Н+/К+-АТФаза не доступны для циркулирующих антител, а пассивный транспорт этих антител в эксперименте не приводил к развитию гастрита.
Скорее всего, основным повреждающим фактором при аутоиммунном гастрите являются Т-клетки CD4+, направленные против компонентов париетальных клеток, включая Н /К -АТФазу. Это подтверждается выработкой Н+/К+-АТФазных аутоантител и развитием гастрита при переносе неиммунным мышам Н+/К+-АТФаза-реактивных Т-клеток CD4+. Однако четких данных об аутоиммунной природе повреждения главных клеток нет. Предположительно они исчезают вследствие разрушения желудочных желез из-за аутоиммунного поражения париетальных клеток.
Если аутоиммунное разрушение контролировать с помощью иммуносупрессоров, железы могут восстановиться, что подтверждает факт выживания желудочных стволовых клеток и способность их дифференцироваться в париетальные и главные клетки.
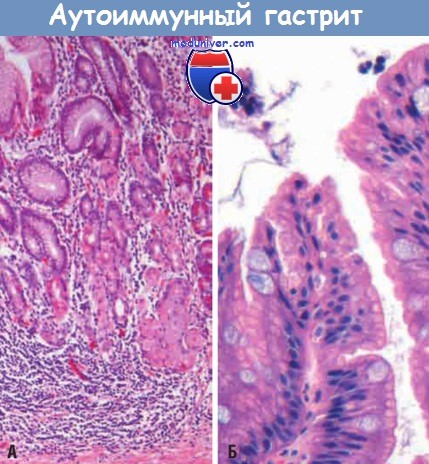
(А) Слизистая оболочка тела желудка с признаками выраженной воспалительной инфильтрации преимущественно лимфоцитами и атрофией желез (малое увеличение).
(Б) Кишечная метаплазия, представленная бокаловидными клетками в покровноямочном эпителии желудка.
б) Морфология. Аутоиммунный гастрит характеризуется диффузным поражением кислотопродуцирующей слизистой оболочки тела и дна желудка. Поражение антрального и кардиального отделов обычно отсутствует или выражено слабо. При диффузной атрофии кислотопродуцирующая слизистая оболочка тела и дна желудка заметно истончается, а желудочные складки исчезают. При выраженном дефиците витамина В12 в эпителиальных клетках отмечается увеличение ядер (мегалобластные изменения).
Воспалительный инфильтрат обычно представлен лимфоцитами, макрофагами и плазматическими клетками, но в нем также могут присутствовать и нейтрофилы. Иногда определяются лимфоидные скопления. Типичные для хеликобактерассоциированного гастрита плазматические клетки в поверхностных отделах собственной пластинки слизистой оболочки желудка при аутоиммунном гастрите обычно отсутствуют, а воспалительный инфильтрат расположен, как правило, глубоко, вблизи желудочных желез.
Утрата париетальных и главных клеток может быть весьма выраженной. При неполной атрофии сохранившиеся островки кислотопродуцирующей слизистой оболочки могут иметь при эндоскопии вид множественных мелких полипов или узелков. Также могут быть заметны мелкие поверхностные возвышения слизистой оболочки, соответствующие участкам кишечной метаплазии и характеризующиеся наличием бокаловидных и абсорбирующих цилиндрических клеток.
Гиперплазия эндокринных клеток в антральном отделе, развивающаяся у большинства пациентов с аутоиммунным гастритом, часто трудноразличима при окрашивании гематоксилином и эозином, поскольку эндокринные клетки (также называемые энтерохромаффиноподобными клетками) при рутинном окрашивании распознать нелегко. Гиперплазия коррелирует со степенью атрофии слизистой оболочки и является физиологической реакцией на снижение продукции соляной кислоты.
Со временем гипергастринемия может стимулировать эндокринно-клеточную гиперплазию в области дна и тела желудка. Реже эндокринно-клеточная гиперплазия прогрессирует до мелкой мультицентрической нейроэндокринной, или карциноидной, опухоли низкой степени злокачественности.

в) Клинические признаки. На ранней стадии заболевания в крови обнаруживаются антитела к париетальным клеткам и внутреннему фактору. Атрофия слизистой оболочки желудка развивается в течение 20-30 лет, а анемия возникает лишь у небольшого количества пациентов. Из-за вариабельности течения заболевания и отсутствия явных симптомов аутоиммунный гастрит обычно диагностируют через много лет после его манифестации. Средний возраст пациентов к моменту постановки диагноза составляет 60 лет. Несколько чаще аутоиммунный гастрит выявляют у женщин.
Пернициозная анемия и аутоиммунный гастрит нередко сопровождаются другими аутоиммунными заболеваниями, например тиреоидитом Хашимото, сахарным диабетом типа I, болезнью Аддисона, первичной недостаточностью яичников, первичным гипопаратиреозом, болезнью Грейвса, витилиго, миастенией гравис, синдромом Ламберта-Итона.
Связь между аутоиммунным гастритом и перечисленными заболеваниями, а также конкордантность у некоторых монозиготных близнецов и наличие семейных случаев заболевания подтверждают генетическую предрасположенность к аутоиммунному гастриту. Около 20% родственников лиц с пернициозной анемией также имеют аутоиммунный гастрит, но он может протекать бессимптомно. Несмотря на четкую генетическую предрасположенность, аутоиммунный гастрит значительно отличается от других аутоиммунных заболеваний, поскольку только в некоторых случаях доказана его связь со специфическими аллелями HLA.
Клинические проявления аутоиммунного гастрита могут быть представлены симптомами пернициозной анемии. Кроме того, дефицит витамина В12 может вызвать атрофический глоссит (язык становится гладким и приобретает ярко-красный цвет), а также эпителиальный мегалобластоз и диарею, возникающую вследствие нарушения всасывания. Дефицит витамина В12 может вызвать периферическую нейропатию, поражение спинного мозга и нарушение функции центральной нервной системы.
Патологическими изменениями со стороны нервной системы могут быть демиелинизация, дегенерация аксонов и гибель нейронов. Самыми частыми проявлениями периферической нейропатии являются парестезии и онемение. Спинальные поражения иногда сопровождаются потерей вибрационной чувствительности и ориентации, сенсорной атаксией с положительным симптомом Ромберга, слабостью в конечностях, мышечными спазмами и появлением подошвенного рефлекса. Церебральные проявления варьируют от легких изменений личности и нарушения памяти до психоза. В отличие от пернициозной анемии неврологические нарушения при аутоиммунном гастрите не купируются после заместительной терапии витамином B12.
- Рекомендуем ознакомиться со следующей статьей "Механизм развития (патогенез) редких форм хронического гастрита"
Оглавление темы "Патогенез болезней пищевода и желудка":- Механизм развития (патогенез) аденокарциномы пищевода
- Механизм развития (патогенез) плоскоклеточного рака пищевода
- Механизм развития (патогенез) доброкачественной опухоли пищевода
- Механизм развития (патогенез) острого гастрита
- Механизм развития (патогенез) острой язвы желудка
- Механизм развития (патогенез) связанного с хеликобактер гастрита
- Механизм развития (патогенез) аутоиммунного гастрита
- Механизм развития (патогенез) редких форм хронического гастрита
- Механизм развития (патогенез) язвенной болезни
- Механизм развития (патогенез) атрофии и дисплазии слизистой желудка

