Имплантация нейральных стволовых клеток. Миграция нейральных стволовых клеток
Само по себе FHL- или SFHL-активирование in vitro не приводит к образованию зрелых нейронов, и попытались установить, способны ли преформированные с помощью FHL или SFHL стволовые клетки дифференцироваться в холинергические нейроны при трансплантации в ЦНС половозрелой крысы. Для этого была проведена инъекция активированных клеток в нейрогенную зону (гиппокамп) и в несколько ненейрогенных зон, включая предфронтальный участок коры головного мозга, среднюю мембрану и спинной мозг взрослых крыс.
Отслеживание имплантированных клеток проводили с помощью CAG-egftp вектора. Известно, что GFP маркирует одновременно как ультраструктуры клетки, так и клеточные процессы (молекулярный уровень) без утечки и поддается прямой визуализации. Кроме того, GFP-меченые нейральные стволовые клетки поддерживают профиль нейрональной и глиальной дифференциации, идентичный профилю непреобразованных стволовых клеток эмбрионального мозга (Wu et al., 2002).
Через одну-две недели после имплантации 5 х 104 активированных и маркированных нейральных стволовых клеток они были обнаружены в спинном или головном мозге крыс, при этом GFР+-клетки находились, главным образом, возле места инъекции. Процессы миграции и интеграции наблюдались уже через месяц после трансплантации. Пределы миграции менялись в зависимости от места инъекции: при введении в предфронтальный участок коры головного мозга GFР+-клетки располагались в 0,4-2 мм от зоны введения, в случае же имплантации в среднюю мембрану, гиппокамп или спинной мозг клетки мигрировали на гораздо большие расстояния — до 1-2 см.
Трансплантированные клетки локализовались в высокоорганизованных структурах ЦНС, включая фронтальную область коры головного мозга, среднюю мембрану, гиппокамп и спинной мозг. GFP-маркированные нейрональные элементы просматривались уже на 1-й неделе после трансплантации, при этом их количество значительно возросло через 1 месяц после операции. Стереологический анализ показал более высокий уровень выживаемости имплантируемых клеток в различных структурах головного мозга, по сравнению со спинным (Wu et al., 2002).
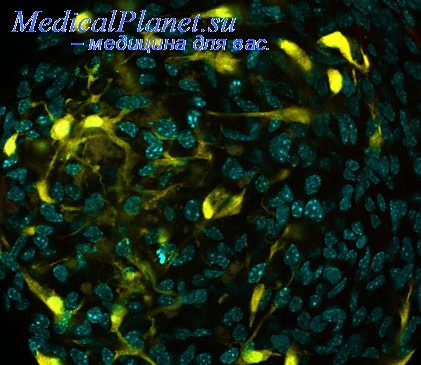
Авторы провели весьма корректную и показательную "чистку" результатов эксперимента путем исключения возможности получения клетками-хозяевами gfp ДНК или GFP посредством утечки из поврежденных эмбриональных клеток — все GFF^-клетки давали специфически локализованную позитивную реакцию на моноклональные антитела к ядрам человека при негативном ответе на антитела к цитохрому Р450 крысы. Морфологический анализ клеточных трансплантатов показал, что GFР+-клетки в пирамидальном клеточном слое зоны СА1 гиппокампа приобрели типичные характеристики пирамидных нейронов.
Иммуноцитохимически с помощью нейронспецифических маркеров NeuN и TuJl установлено, что большинство GFР-клеток получили нейрональную маркировку через 1 месяц после трансплантации в кору головного мозга, гиппокамп, среднюю мембрану и спинной мозг. Лишь несколько разрозненных GFР+-клеток характеризовались двойной маркировкой с экспрессией астроцитспецифического GFAP. Реакция на галактоцереброзид была негативной у всех СРР+-клеток, что указывает на отсутствие их дифференцировки в линию олигодендроцитов, а негативный результат окрашивания на выявление нестина свидетельствует о том, что через 1 месяц после трансплантации все трансплантированные клетки подверглись дифференцировке.
Чтобы исключить возможность влияния экспрессии GFP в нейральных стволовых клетках на процессы их нейронального преобразования, авторы трансплантировали CAG-egfp-обработанные, но не преформированные FHL клетки в спинной мозг, кору головного мозга, среднюю мембрану и гиппокамп. Около 70% прижившихся клеток через 1 месяц после трансплантации оставались нестинпозитивными, а в изучаемых ненейрогенных зонах приобретали астроглиальный фенотип. Большинство GFР+-холинергических нейронов было выявлено в средней мембране и спинном мозге, а также в зонах головного мозга реципиента с высоким содержанием эндогенных СhAT+-нейронов. Несколько GFP/ChA+-нейронов обнаружены авторами в предфронтальном участке коры головного мозга, где содержится ограниченное количество эндогенных СhА'Р-нейронов. Не удалось выявить GFPyChA'P-HeupoHbi в гиппокампе, где холинергические нейроны вообще отсутствуют.
В спинном мозге некоторые из трансплантированных СhА+-нейронов имели размер и морфологию, неотличимую от эндогенных мотонейронов. Следовательно, образование СhAT+-нейронов было обусловлено воздействием факторов специфического микроокружения зоны локализации исходного клеточного материала (Wu et al., 2002). Кроме того, значительное количество GFPyChAT-нейронов обнаружено в средней мембране (61%) и спинном мозге (55%) при их отсутствии в предфронтальном участке коры головного мозга и гиппокампе. Поскольку средняя мембрана и спинной мозг являются участками ЦНС, содержащими холинергические нейроны, в то время как два других региона их практически не имеют, этот факт подтверждает специфичность регионарной индуцированной дифференцировки нейральных стволовых клеток.
Однако сами авторы не исключают возможность не инструктивного, а селективного эффекта (преимущественное выживание холинергических нейронов в холинергических зонах средней мембраны и спинного мозга). Решение вопроса об использовании FHL-преформированных нейральных стволовых клеток с целью коррекции двигательных нарушений путем функциональной замены погибших мотонейронов с широкомасштабным применением технологий заданного преформирования стволовых клеток эмбрионального мозга для лечения различного рода неврологических заболеваний авторы оставляют на будущее (Wu et al., 2002).
- Читать далее "Трансплантация эмбриональной нервной ткани. Трансплантация клеток в спинной мозг"
Оглавление темы "Применение стволовых клеток в неврологии":1. Митогены нейральных стволовых клеток. Реагрегация нейральных стволовых клеток
2. Культивирование нейральных прогениторных клеток. Нейротрофические факторы
3. Применение стволовых клеток в неврологии. Преформация нейральных стволовых клеток
4. Имплантация нейральных стволовых клеток. Миграция нейральных стволовых клеток
5. Трансплантация эмбриональной нервной ткани. Трансплантация клеток в спинной мозг
6. Трансплантация нервов. Трансплантация при черепно-мозговых травмах
7. Посттравматические осложнения. Трансплантация при детском церебральном параличе
8. Эффективность трансплантации эмбриональной нервной ткани. Апаллический синдром
9. Эффекты эмбриональной нервной ткани. Эмбриональная ткань как стимулятор роста аксонов
10. Гемопоэтические стволовые клетки. Особенности гемопоэтических стволовых клеток

