Техника получения линий стволовых клеток. Селекция чистой популяции стволовых клеток
Отработанная стандартная техника получения линий стволовых клеток из бластоцист приведена в лабораторных пособиях по технике эксперимента с ранними зародышами (Robertson, 1987; Hogan et. ai, 1994). Экспериментальные линии ЭСК можно получить и при культивировании изолированного эпибласта (первичной эктодермы) 4,5-дневных мышиных зародышей с помощью довольно сложной микрохирургической техники и модифицированных условий культивирования.
Трудоемкость этой процедуры оправдана, поскольку частота образования линий эмбриональных стволовых клеток при этом оказалась значительно выше, чем в работах с внутренней клеточной массой бластоцисты (Brook, Gardner, 1997; Дыбан А., Дыбан П., 2002).
Для выделения линий эмбриональных стволовых клеток каждый клон переносят в микролунку, выращивают агрегат из 40-60 клеток, вновь его диспергируют. Многократное повторение такой процедуры позволяет получить иммортализованную линию ЭСК с максимальной скоростью пролиферации нормокариотипных клеток, прикрепленных к пластику, которые через 50-100 пассажей сохраняют тотипотентность и высокую активность теломеразы.
В процессе поддержки линий эмбриональных стволовых клеток наибольшую опасность представляет загрязнение среды или сыворотки бактериальными эндотоксинами — даже следовые концентрации эндотоксина в среде культивирования вызывают массовую гибель незрелых зародышевых клеток (Thomson et ai, 1998). При тщательном контроле за линейным ростом и своевременном диспергировании ЭСК в культуре способны к симметричному делению, при котором обе дочерние клетки остаются плюрипотентными и способными осуществлять неограниченное количество клеточных циклов, сохраняя диплоидный кариотип и тотальную потентность (Rathjen J., Rathjen P., 2001; Smith, 1992, 2001; Дыбан А., Дыбан П., 2002).
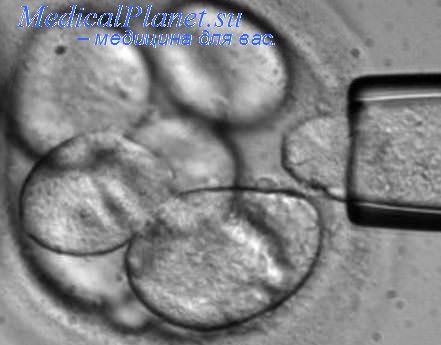
Селекцию чистой популяции эмбриональных стволовых клеток человека можно проводить после трансфекции в их геном рекомбинантных молекул ДНК, содержащих ген, кодирующий синтез зеленого флуоресцентного белка (GFP) (Cherny, 1994; Mountford, 1998). Экспрессия GFP увеличивается при выращивании ЭСК в условиях, поддерживающих их пролиферацию, тогда как с началом дифференцировки уровень экспрессии этого гена снижается, что позволяет отбирать на селективной среде чистые стабильные плюрипотентные клеточные линии. При культивировании выделенных с помощью GFP-селекции ЭСК частота образования колоний во много раз возрастает, поскольку в условиях селекционных культур устраняется мощный антипролиферативный эффект дифференцированных клеток (Morrison et. al., 1997; Peru, 2001).
Перевод эмбриональных стволовых клеток человека в линию осуществляется с помощью метода их выделения из доимплантационных зародышей (на стадии 80-120 клеток), которые остаются после процедуры оплодотворения in vitro (Thomson et. al., 1998). Для этого искусственно полученные "избыточные" зародыши механически диспергируются в среде Дельбекко-Игла. После маркировки клеток селективными моноклональными антителами с флюоресцентной меткой изолируются клетки эмбриобласта.
Эмбриобласт диспергируется на отдельные клетки с помощью смеси диспазы-коллагеназы. Диссоциированные клетки выращиваются в специальной среде (80% среды Дельбекко +20% фетальной телячьей сыворотки в присутствии 500 мкг/мл IL-6, LIF и SCF) над фидерным монослоем эмбриональных фибробластов первых 3 пассажей. При этом выживаемость и пролиферация стволовых и прогениторных клетек поддерживается за счет воздействия на них IL-6, LIF и SCF В такой среде ЭСК растут суспензионными клонами неприкрепленных ошаренных клеток, которые необходимо диссоциировать мягким многократным пипетированием.
Второй метод выделения линий эмбриональных стволовых клеток человека основан на использовании первичных половых клеток. Экспериментальные исследования показали, что линии EG-клеток можно получить из половых валиков 12,5-дневных эмбрионов мышей. Однако в этих случаях частота образования прогениторных клеточных линий была значительно ниже, чем в опытах с более ранними зародышами. При этом первичные половые клетки из гонад мышиных зародышей 13,5-дневного гестационного возраста вообще не способны трансформироваться в линии (Labosky et. al., 1994).
- Читать далее "Выделение линий первичных половых клеток. Пролиферация первичных половых клеток"
Оглавление темы "Культура эмбриональных стволовых клеток":1. Техника культивирования эмбриоидных телец. Гибридные клетки
2. Стволовые клетки из трофобласта. Выделение линий эмбриональных стволовых клеток
3. Техника получения линий стволовых клеток. Селекция чистой популяции стволовых клеток
4. Выделение линий первичных половых клеток. Пролиферация первичных половых клеток
5. Выделение эмбриональных стволовых клеток. Среды размножения стволовых клеток
6. Функциональная роль LIF. Влияние LIF на ткани
7. Влияние LIF на эмбрионы. Фенотипические особенности эмбриональных стволовых клеток
8. Пролиферация эмбриональных стволовых клеток. Клональный рост эмбриональных стволовых клеток
9. Состав клона эмбриональных клеток. Плюрипотентность эмбриональных стволовых клеток
10. Регенеративные возможности эмбриональных стволовых клеток. Генные маркеры клеток зародышевых листков

